Activité chimique - Définition
L'activité chimique d'une espèce est l'influence de la quantité d'une espèce sur l'énergie libre d'un système. Elle se note a.
Le potentiel chimique µi d'une espèce i est la dérivée partielle de l'Enthalpie libre (ou énergie libre de Gibbs) du système par rapport à la quantité ni de i (nombre de moles) :
Ce potentiel chimique dépend de la température T, de la pression p et de l'activité ai selon la formule :
où R est la constante des gaz parfaits et µi0 est la valeur de µi dans des conditions de référence.
Cas d'un composé dans un mélange gazeux
L'activité s'exprime sous la forme :
Où γi est le coefficient d'activité (sans dimension) de l'espèce i, xi la fraction molaire du composé dans le mélange gazeux et p sa pression exprimée en bar.
La quantité fi a la dimension d'une pression et est nommée fugacité : pour un gaz parfait pur, le coefficient de fugacité est égal à 1.
p0 est la pression standard. Elle vaut 1 bar et sert ici uniquement à retirer les dimensions de la relation. On a alors :
Cas d'un composé dans une solution liquide
L'activité s'exprime sous la forme :
Où γi est le coefficient d'activité de l'espèce i, Ci sa concentration en solution exprimée en mol·l-1. Le terme C0 vaut 1 mol·l-1 et sert ici uniquement à retirer les dimensions de la relation. On a alors :
On notera que dans une solution liquide le coefficient d'activité d'un ion donné (ex : Ca2+,…) n'est pas mesurable car il est expérimentalement impossible de mesurer indépendamment le potentiel électrochimique d'un ion en solution. C'est pourquoi on introduit la notion de coefficient d'activité moyen.
Simplification
On simplifie parfois les relations ci-dessus en considérant que :
- Pour une solution :
- le solvant a une activité égale à 1
- l'activité d'un soluté est égale au rapport de sa concentration avec une concentration de référence tant que celle-ci a des valeurs faibles ;
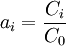
Concrètement, elle est égale à sa concentration en mol·l-1 ;
- Pour un mélange de gaz : l'activité est égale au rapport de la pression partielle du gaz sur la pression de référence, tant que cette pression garde des valeurs faibles ;
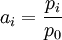
Concrètement, elle est égale à la pression partielle en bar (en prenant une pression de référence de 1 bar) - Pour un corps solide : un solide, seul dans sa phase, a une activité de 1.
L'activité chimique intervient dans la définition de la constante d'équilibre.