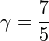Expérience de Clément-Desormes - Définition
L'expérience permet d'évaluer le coefficient ![]() , d'un gaz parfait, où :
, d'un gaz parfait, où :
- CP est la capacité thermique isobare
- CV est la capacité thermique isochore
On peut obtenir le résultat de deux manières :
- en comparant la pente de l'adiabatique et celle de l'isotherme.
- en faisant un calcul à l'ordre 1.
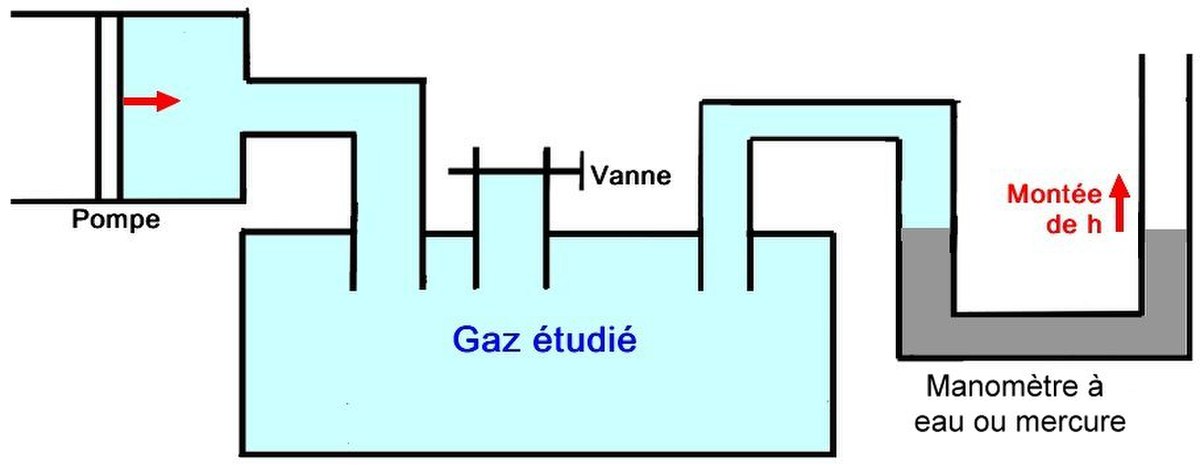
Description de l'appareil
On dispose d'un récipient empli du gaz que l'on souhaite étudier, couplé à un manomètre. On crée dans le récipient une petite surpression, qui s'accompagne inévitablement d'une élévation de ![]() du niveau du manomètre.
du niveau du manomètre.
Mesure
On ouvre la vanne. La pression retombe à la pression P° extérieure. On referme immédiatement la vanne. Le gaz à l'intérieur, refroidi par la détente, va maintenant revenir à la température de la salle T°. À la fin de ce processus, on obtient au manomètre une dénivellation ![]() .
.
Résultat et précision
On obtiendra alors : ![]()
Le manomètre, souvent à mercure, peut être à eau : la hauteur h1 sera alors 13,6 fois celle du mercure. Cela peut améliorer la précision de la mesure.
En revanche, h2 n'intervient que pour sa différence avec h1 : la précision sur une différence est mauvaise.
On n'attend que des résultats en ordre de grandeur. On peut toutefois espérer estimer les erreurs car théoriquement, γ vaut :
- pour un gaz parfait monoatomique
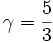
- pour un gaz parfait diatomique