Noyau atomique - Définition
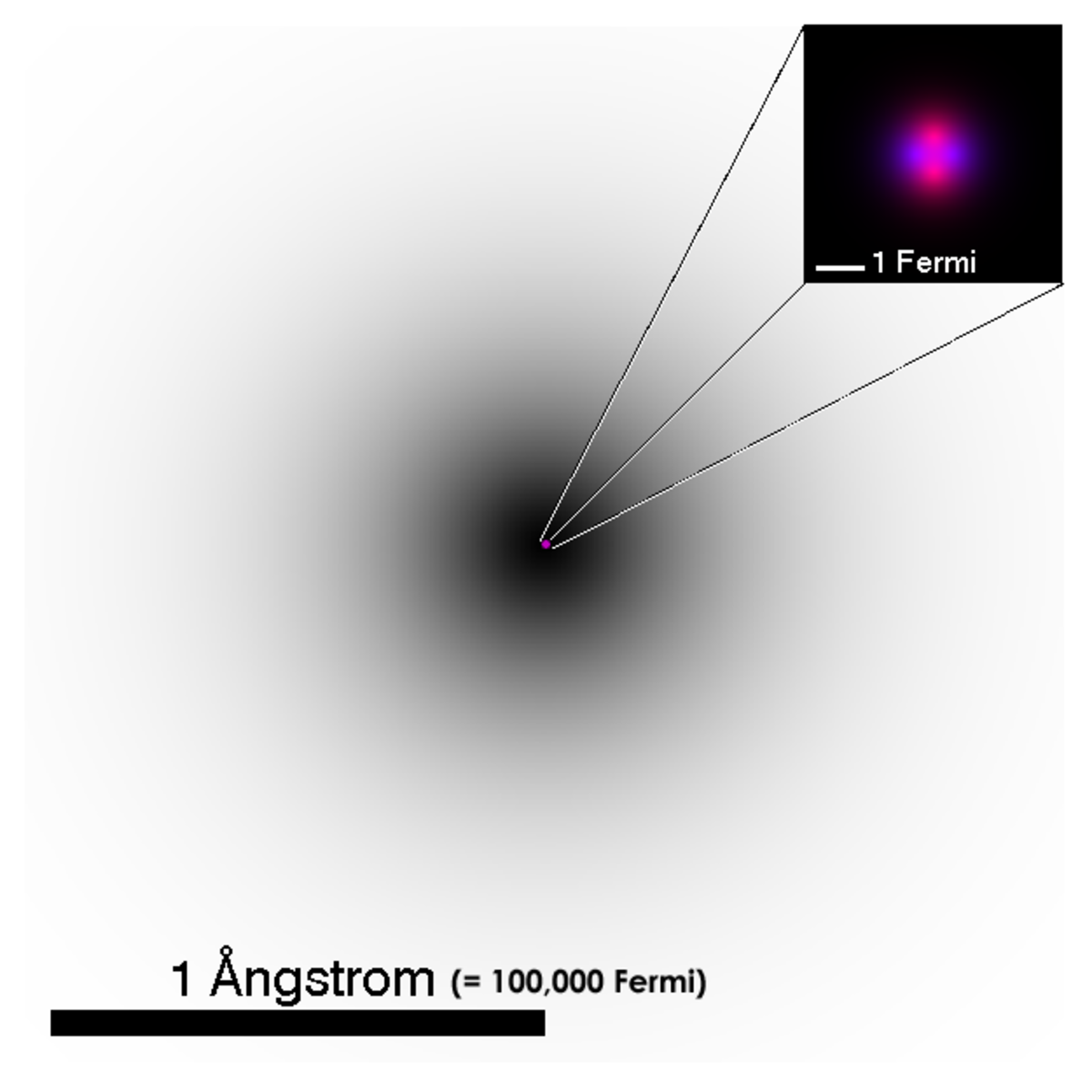
Le noyau atomique désigne la région située au centre d'un atome constituée de protons et de neutrons (les nucléons). La taille du noyau (10-15 m) est considérablement plus petite que celle de l'atome (10-10 m) et concentre quasiment toute sa masse.
Caractéristiques physiques
L'atome a une structure lacunaire, c’est-à-dire qu'entre les électrons et le noyau il n'y a que du vide.
Composition
Le noyau d'un atome est composé de nucléons extrêmement liés (à l'exception de l'hydrogène dont le noyau est simplement constitué d'un unique proton). Sa cohésion est assurée par l'interaction forte, force prépondérante à l'échelle du noyau, qui maintient les nucléons ensemble et les empêche de s'éloigner les uns des autres.
Pour modéliser cette attraction entre les nucléons, on peut définir une énergie de liaison pouvant être calculée à partir de la formule de Bethe-Weizsäcker.
Isotopes
Les isotopes sont des atomes ayant des nombres identiques de protons (même numéro atomique Z) mais des nombres de neutrons différents (nombre de masse A).
Un élément est caractérisé par le nombre de protons qui composent son noyau, précisément appelé numéro atomique et noté Z ; un atome possédant autant d'électrons que de protons, Z est également le nombre d'électrons d'un élément.
Pour un même élément, il est possible d'obtenir différents nucléides correspondant à des nombre de neutrons différents. Les nucléides de même numéro atomique Z sont appelés isotopes de l'élément ayant ce numéro atomique. Le nombre de masse A d'un atome est le nombre total de nucléons qui le composent. Le nombre de neutrons N est égal à A - Z.
Un nucléide X est donc un atome caractérisé par son nombre de masse A et son numéro atomique Z ; il est noté AZX (lire X A, le numéro atomique étant implicite).
Par exemple, l'hydrogène 11H, le deutérium D ou 21H et le tritium T ou 31H sont trois isotopes de l'hydrogène.
Différents isotopes d'un même élément possèdent des propriétés chimiques similaires, car elles dépendent essentiellement de son nombre d'électrons. Leur stabilité et demi-vie peuvent cependant être différentes et leur masse atomique distincte permet de les séparer à l'aide d'une centrifugeuse ou d'un spectromètre.
Masse atomique
La masse atomique isotopique d'un élément est la masse correspondant à NA nucléides de ce même isotope, NA étant le nombre d'Avogadro (environ 6,022 04×1023).
La masse atomique d'un élément chimique est la moyenne pondérée des masses atomiques de ses isotopes naturels ; certains éléments chimiques possèdent des isotopes radioactifs à très longue période, et par conséquent leur composition isotopique naturelle, ainsi que leur masse atomique évolue sur de longues périodes de temps, telles que les ères géologiques. C'est notamment le cas pour l'uranium.
Stabilité
La stabilité d'un noyau atomique dépend du nombre de nucléons qui le composent. Certains noyaux sont stables, c'est-à-dire que leur énergie de liaison est suffisante, rendant alors leur durée de vie illimitée. D'autres sont instables et tendent à se transformer spontanément en un noyau plus stable par émission d'un rayonnement. Ou plus précisément, la transformation (spontanée) de la radioactivité se produit toujours selon une augmentation de l'énergie de liaison moyenne des nucléons concernés.
Exemple : l'Uranium 235 et 238 ont des demi-vies supérieures à ceux de leur "famille" respective avant de mener aux isotopes stables du Plomb.
- Radioactivité α s'il émet un ou plusieurs nucléons (proton, neutron ou particule α)
- Radioactivité β s'il émet un électron ou un positron.
Ces deux types de radioactivité sont la plupart du temps accompagné d'un rayonnement gamma (émission de photons) ou de neutrinos.
Par exemple, l'azote-16 (16 nucléons, 7 protons, 9 neutrons) se transforme en oxygène-16 (16 nucléons, 8 protons, 8 neutrons) quelques secondes après sa création par radioactivité bêta : l'interaction faible transforme l'un des neutrons du noyau en un proton et un électron, modifiant ainsi le numéro atomique de l'atome.
La demi-vie d'un isotope est la période au bout de laquelle, statistiquement, la moitié des atomes d'un échantillon initial se seront désintégrés. Les noyaux peuvent posséder des demi-vies très différentes : couvrant en fait toute la plage des durées !
Depuis l'infime fraction de seconde, où le noyau est dans son état 'normal', fondamental lorsqu'il a plus la trace de sa dernière (trans-)formation : ~1015 s (?)
| intervalle de durée | Isotope | Demi-vie |
|---|---|---|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
En fait, les noyaux dits stables ne le sont que dans la mesure où ils avoisinent celle du proton, seul baryon (méta?)stable. Le proton a une demi-vie (théorique) d'environ 1033 ans !
Mais les expériences menées pour mesurer cette désintégration du proton, véritable pierre angulaire de la matière, n'ont pas vérifiées cette prédiction. Le proton serait plus stable que prévu...[1].
Taille et forme
Le rayon d'un nucléon est de l'ordre de 10-15 m, soit 1 fm (le terme de rayon s'entend ici au sens d'avoir une probabilité suffisante de détecter le nucléon dans le volume d'espace considéré). Cela vaut moins de 0,01 % du rayon total de l'atome. La densité du noyau est donc considérablement plus grande que celle de l'atome même. Cette densité est à peu près constante pour tout les noyaux dans leur état fondamental (non excité) ; environ 200 millions de tonnes au cm³ : la densité du fluide nucléaire.
La taille et la forme réelles d'un noyau spécifique dépendent fortement du nombre de nucléons qui le composent, ainsi que de leur état énergétique. Les noyaux les plus stables ont en général une forme sphérique au repos et peuvent prendre, par exemple, la forme d'un ellipsoïde s'ils sont excités.
Dans le cas des noyaux à halo, quelques nucléons seraient situés à une distance nettement plus grande des autres, entourant donc d'un halo le noyau plus compact formé par les autres nucléons. Le lithium 11 semble par exemple composé d'un noyau de lithium 9 (l'isotope le plus stable) entouré d'un nuage de deux neutrons ; sa taille est alors comparable à celle du plomb 208 qui possède 20 fois plus de nucléons.