Restez toujours informé: suivez-nous sur Google Actualités (icone ☆)
Une équipe internationale de chercheurs, sous l'égide de l'Université de Leicester et de l'Institut Laue-Langevin, a élucidé une énigme de la biologie en identifiant la structure d'un intermédiaire essentiel de la réaction enzymatique. Le problème – qui a agité la communauté scientifique pendant des années se réduit à cette simple question: présence d'un atome d'hydrogène, oui ou non ?
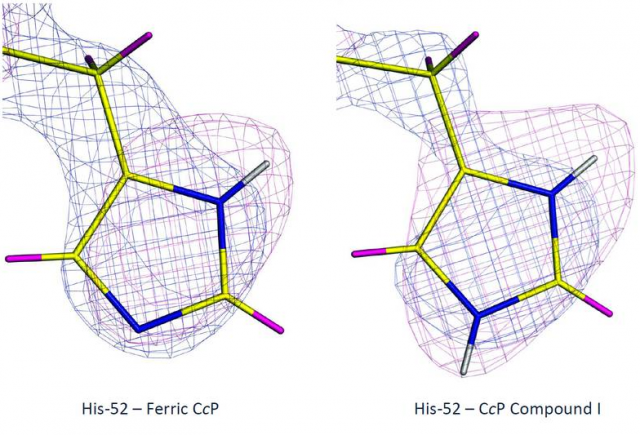
histidine 52 dans les deux états de l'enzyme. Illustration: ILL
Le débat se focalise sur une famille d'enzymes appelés enzymes hèmes, en raison de la présence d'un groupe hème sur leur site actif. Au centre du cofacteur hème il y a un atome de fer (Fe), qui s'oxyde lorsqu'un hème réactif se trouve dans un état intermédiaire appelé Composé I. La question restée sans réponse durant des décennies était de savoir si cette oxydation implique seulement un atome d'oxygène (O), ou un groupe hydroxyle (OH). Or, la réponse à cette question fondamentale a des implications sur la compréhension des processus d'oxydation dans les cellules vivantes, tout à fait essentielle pour la mise au point de médicaments.
Les Professeurs Peter Moody et Emma Raven, de l'Université de Leicester, ont travaillé avec le Dr Matthew Blakeley, le Dr Susana Teixeira et Cecilia Casadei de l'Institut Laue-Langevin, les scientifiques du Maier-Leibnitz Zentrum (MLZ) et l'Université de Manchester pour résoudre le mystère de la structure du Composé 1 de l'hème "ferryle" avec une méthode jamais encore appliquée à ce problème: la cristallographie neutronique.
La structure des protéines est normalement déterminée par la cristallographie, diffraction des rayons X, néanmoins, les atomes d'hydrogène ne sont généralement pas localisés en raison de leur faible dispersion aux rayons X. En revanche, la cristallographie neutronique des protéines permet la localisation des atomes d'hydrogène tout en évitant la dégradation de l'échantillon par les radiations, que peuvent causer les rayons X.
L'enzyme utilisée dans l'étude est le cytochrome c peroxydase (CcP), qui a été isolé, purifié et cristallisé en préparation de l'étude neutronique. Tout d'abord, la structure neutronique du CcP au repos à température ambiante a été déterminée à partir de données recueillies par l'appareil LADI-III de l'ILL. Ensuite, on a provoqué une réaction avec du peroxyde d'hydrogène pour former l'intermédiaire Composé I, immédiatement refroidi à -173° pour figer cet état intermédiaire. Puis les données neutroniques ont été collectées sur le cristal de Composé 1 aux températures cryogéniques avec l'appareil BioDiff de FRM II, permettant de déterminer la structure neutronique du Composé 1.
Et la réponse est... l'hème "ferryle" du Composé I n'est pas protoné. Mais, et c'est une surprise, les résultats ont montré que la chaîne latérale d'un acide aminé (une histidine) sur la molécule est doublement protonée, ce qui pose d'autres questions spécifiques en termes de mécanismes de l'activation de l'oxygène dans les enzymes à hèmes.
"Le refroidissement par cryogénie de grands cristaux de protéines, nécessaire pour la cristallographie neutronique, était généralement vu comme un défi", explique Cecilia Casadei, doctorante à l'ILL. "Notre travail montre que c'est possible, permettant ainsi la capture à basse température d'espèces intermédiaires dans la réaction enzymatique par cristallographie neutronique. L'appareil LADI-III de l'ILL et le BioDiff de FRM II exploitent les possibilités uniques de la diffraction neutronique pour la localisation des atomes d'hydrogène dans la structure des protéines, si souvent essentielle à la complète compréhension des mécanismes de réaction et de l'activité catalytique."
"Cette étude marque la première détermination d'une structure intermédiaire par cryo-cristallographie neutronique, éclairant un mécanisme catalytique bien connu mais confus", selon Matthew Blakeley, responsable LADI-III à l'Institut Laue-Langevin. "La possibilité de collecter des données à différentes températures nous permet maintenant de traiter de problèmes biologiques bien plus complexes en utilisant la cristallographie neutronique."
"Situer tous les atomes d'hydrogène, c'est la clé pour comprendre le fonctionnement des enzymes," précise le professeur Moody. "La capacité de figer les intermédiaires à des températures cryogéniques associée à l'information apportée par la cristallographie neutronique, signifie que l'on peut enfin les voir."
"La structure exacte du hème "ferryle" est longtemps restée un problème difficile à résoudre pour la communauté de spécialistes", explique le professeur Raven. "Nous avons eu la chance, via nos collaborateurs à Grenoble et Munich, d'avoir accès à l'excellence des appareils à faisceaux de neutrons en Europe et de nous trouver ainsi dans une situation optimale pour essayer de nouvelles approches qui ont fort bien fonctionné."
Pour plus d'information voir: http://www.sciencemag.org/content/345/6193/193.abstract
Populaires