Restez toujours informé: suivez-nous sur Google Actualités (icone ☆)
Plusieurs affections neurodégénératives sont causées par des agrégats d'une même protéine, l'alpha-synucléine, dans le cerveau. Une équipe franco-belge (1) incluant des chercheurs de l'Institut des neurosciences Paris Saclay (CNRS/Université Paris-Sud) a identifié deux formes spécifiques des fibres de cette molécule, en forme de "linguines" et de "spaghettis" et prouvé qu'elles provoquent respectivement la maladie de Parkinson et l'atrophie multi-systématisée (AMS). Ces travaux sont publiés dans la revue Nature le 10 juin 2015.
À l'instar de nombreuses autres protéines, la fonction exacte de l'alpha-synucléine pour le système nerveux n'est pas connue. Elle jouerait un rôle important dans les synapses, mais cette macromolécule peut aussi s'agréger sous forme fibrillaire dans le cerveau. Elle constitue alors des corps de Lewy (2), qui sont à l'origine de diverses maladies neurodégénératives comme celle de Parkinson, l'atrophie multi-systématisée ou la démence à corps de Lewy. L'équipe dont fait partie Ronald Melki, directeur de recherche CNRS à l'Institut des Neurosciences Paris Saclay, a pu montrer comment une même protéine peut provoquer des maladies qui n'affectent pas les mêmes fonctions cérébrales.

Amas d'alpha-synucléine fibrillaire comme dans les corps de Lewy, observés au microscope électronique. La barre d'échelle correspond à 200 nanomètres.
© Luc Bousset, CNRS
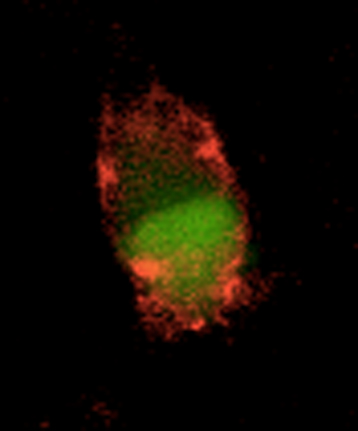
Cellule en culture ayant fixé des fibres d'alpha-synucléine. Le cytoplasme de la cellule est marqué en vert, les fibres fixées sont en rouge. La cellule est observée à travers un microscope à fluorescence.
© Ronald Melki, CNRS
L'alpha-synucléine se structure quand elle polymérise en fibres. Cela aboutit à des solutions très hétérogènes, où des formes fibrillaires nombreuses et variées cohabitent. Comme les chercheurs ne peuvent rien conclure d'un mélange, ils doivent travailler sur une fibre pure à 100 % pour obtenir des résultats interprétables.
La première étape a donc consisté à isoler cinq types de fibres, et a donné lieu à une première publication en 2013 dans Nature Communications (3). Pour les deux formes les plus notables, l'une ressemble "à des pâtes larges, comme des linguines", l'autre "à des pâtes cylindriques pleines, comme des spaghettis".
Ces deux types d'agrégats d'alpha-synucléine ont depuis été injectés séparément dans le cerveau et le sang de rats. Les fibres se sont révélées toxiques pour les neurones et ont recruté l'alpha-synucléine endogène des animaux, ce qui a entrainé la formation de nouveaux agrégats. Les chercheurs savaient déjà que les fibres fonctionnaient comme des prions, mais ils ont aussi pu observer que les agrégats se déplacent le long des axones des neurones.
Les rongeurs ont développé deux formes de synucléinopathie différentes selon ce qui leur avait été inoculé: la maladie de Parkinson et l'atrophie multi-systématisée. Cela prouve bien que des maladies distinctes proviennent de fibres de l'alpha-synucléine qui diffèrent structuralement.
Ces travaux ont également montré que les agrégats qui circulent dans le sang franchissent la barrière hématoencéphalique. La meilleure connaissance des mécanismes de propagation des agrégats de l'alpha-synucléine pourrait déboucher sur le développement d'anticorps ou de dérivés de chaperons moléculaires. Ces molécules, également des protéines, servent à empêcher ou ralentir la formation et la propagation d'agrégats. Cela ouvre aussi la porte à de nouveaux outils de diagnostic précis pour des individus vivants, puisqu'à l'heure actuelle la maladie de Parkinson ne se diagnostique avec certitude qu'après la mort.
Notes:
(1) Les chercheurs sont issus du Laboratoire de neurobiologie et de thérapie génique de l'université catholique néerlandophone de Louvain, de l'Institut des neurosciences Paris Saclay (CNRS/Université Paris-Sud) et du Laboratoire de neurobiologie et neuro-ingénierie de l'université d'Anvers.
(2) Les corps de Lewy sont des agrégats anormaux de protéines à l'intérieur de cellules nerveuses.
(3) Structural and functional characterization of two alphasynuclein strains, L. Bousset.et al. Nature communications, 10 octobre 2013. DOI:10.1038/ncomms3575.
Populaires