Restez toujours informé: suivez-nous sur Google Actualités (icone ☆)
L'oxyde nitrique synthase (NOS) constitue la principale source enzymatique de monoxyde d'azote (NO) chez les animaux. La conservation ou non au plan évolutif de cette enzyme chez les plantes est l'objet d'un débat récurrent depuis une vingtaine d'année. Des chercheurs de l'UMR Agroécologie à Dijon démontrent que les plantes terrestres ne possèdent pas d'enzyme apparentée aux NOS animales. En revanche, cette protéine est conservée chez une quinzaine d'algues vertes. Ces travaux publiés dans la revue Science Signaling, mettent fin au débat et ouvrent de nouvelles perspectives quant au rôle de la NOS chez les algues et à la régulation de la production de NO via le nitrite chez les plantes.
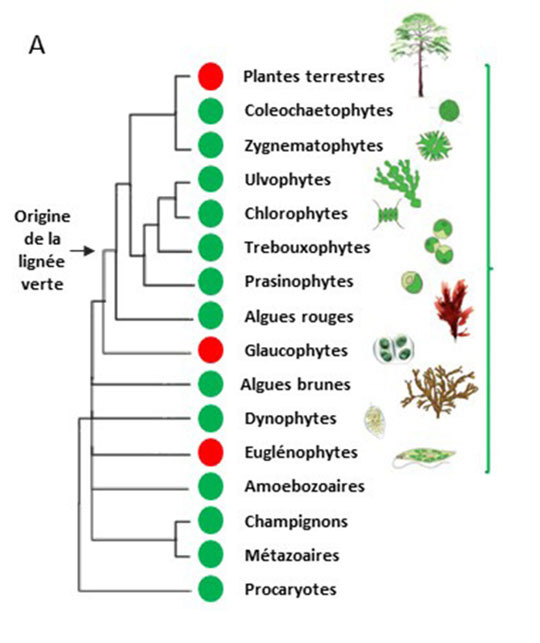
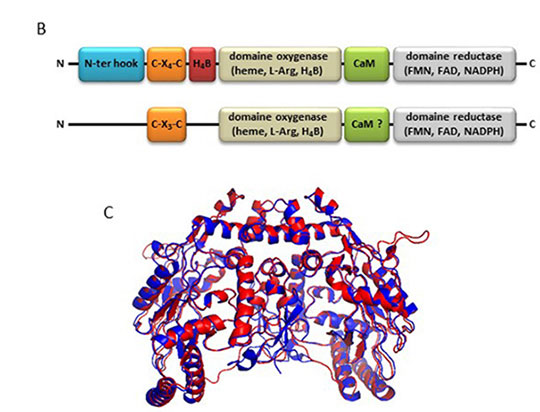
Figure: Distribution et structure des NOS de plantes.
A: Présence des protéines NOS dans le monde vivant (la parenthèse verte délimite les organismes photosynthétiques). L'analyse de la base de données 1KP a permis de mettre en évidence la présence de séquences protéiques similaires aux NOS animales chez plusieurs espèces d'algues (cercles verts). Aucune séquence ne présentant de similarité n'a été détectée chez les plantes terrestres, les glaucophytes et les euglénophytes (cercles rouges).
B: Domaines structuraux des NOS animales et d'algues. Les NOS animales (dessus) sont constituées d'un domaine réductase formé d'un site de fixation du NADPH, du FAD et du FMN, d'un site de fixation de la calmoduline (CaM), d'un domaine oxygénase impliqué dans la fixation de la L-arginine (L-Arg), et du facteur rédox tétrahydrobiopterine (H4B) possédant un noyau héminique. Ces domaines sont conservés dans les NOS d'algues (dessous). La possibilité que ces dernières fixent la CaM n'a pas été démontrée. En revanche, elles sont capables d'utiliser le facteur rédox tétrahydrofolate (THF) à la place du H4B. Dans leur région N-terminale, les NOS animales possèdent 3 résidus impliqués dans la fixation du H4B, un site de fixation du zinc (C-X4-C où X désigne un résidu d'amino-acide) et un domaine hook (N-ter hook). Le site de fixation du zinc et le domaine hook sont associés à l'homodimérisation de l'enzyme. Seul le site de fixation du Zn (C-X3-C) est partiellement conservé chez les NOS d'algues.
C: Superposition du domaine oxygénase (sous sa forme homodimérique) de la NOS de l'algue verte Cosmarium subtumidum (en bleu) et de la NOS endothéliale humaine (en rouge) (modélisation par Swiss Model).
Le NO est une molécule diatomique radicalaire dont le rôle de médiateur physiologique chez les animaux a été démontré il y a un peu plus d'une trentaine d'année. Chez ces organismes, sa synthèse est principalement catalysée par l'Oxyde Nitrique Synthase (NOS) qui utilise la L-arginine comme substrat. Les données accumulées depuis une vingtaine d'années montrent que le NO est également au coeur de divers processus physiologiques chez les plantes. Comparativement aux animaux, il existe une forte conservation des mécanismes par lesquels le NO agit chez les plantes. En effet, celui-ci régule l'activité de protéines par des modifications post-traductionnelles, contrôle la production de messagers secondaires et module l'expression de nombreux gènes. Cette conservation des mécanismes a posé la question de l'existence d'une NOS végétale. Deux principaux arguments ont étayé cette hypothèse: d'une part, des équipes ont pu mesurer des activités NOS à partir d'extraits protéiques de différentes plantes terrestres, d'autre part, des inhibiteurs de NOS animales se sont avérés capables de réduire la production de NO chez les plantes. Sur cette base, la présence chez les plantes d'une protéine dite "oxyde nitrique synthase-like" (NOS-like) est rapportée dans la littérature, même si la ou les protéines correspondantes n'ont pas encore été identifiées. Cette situation est à l'origine de débats parfois conflictuels dans la communauté scientifique s'intéressant au rôle du NO dans la physiologie végétale.
Existe-t-il chez les plantes une protéine apparentée aux NOS animales ? Dans le contexte du consortium international 1KP (http://www.onekp.com/) donnant accès au transcriptome d'environ 1350 espèces végétales incluant des plantes terrestres et des algues, une recherche de la présence de séquences présentant une identité avec la NOS neuronale humaine a été entreprise. Aucune séquence n'a été identifiée chez les plantes terrestres, même chez les espèces où la présence d'une protéine NOS-like avait été proposée. En revanche, sur les 261 algues testées, une quinzaine possèdent des protéines présentant une identité de séquence significative avec les NOS animales. Comparées à ces dernières, les NOS d'algues présentent quelques particularités structurales dont l'absence dans la région N-terminale du motif "N-terminal hook" (voir figure).
Deux questions principales émergent de ce travail:
- Pourquoi retrouve-t-on une NOS uniquement chez quelques espèces d'algues ? Cette question est d'autant plus troublante que les espèces la possédant n'obéissent pas une phylogénie particulière mais sont distribuées de façon plutôt aléatoire. En termes fonctionnels, des premières analyses chez l'algueverte Ostreococcus tauri ont démontré que le NO produit par la NOS est impliquée dans la détoxification de formes réactives de l'oxygène (Foresi et al., Plant Cell 2010). Est-ce que la NOS d'algue présente d'autres fonctions ? Quel avantage sélectif sa présence confère-t-elle ? Ces questions restent ouvertes.
- Pourquoi la NOS n'a-t-elle pas été conservée chez les plantes terrestres ? La réponse à cette question doit tenir compte du processus d'assimilation de l'azote chez les plantes. En effet, les plantes assimilent l'azote du sol principalement nous forme de nitrate. Une fois assimilé, le nitrate est réduit en nitrite par la nitrate réductase. Des travaux ont démontré que cette enzyme peut également réduire le nitrite en NO. De plus, le nitrite peut être réduit en NO non enzymatiquement, par exemple dans des conditions d'hypoxie. Il est donc tout à fait envisageable que les plantes aient optimisé l'utilisation du nitrite comme principale source de NO plutôt que l'oxydation de la L-arginine par la NOS.
Populaires