Restez toujours informé: suivez-nous sur Google Actualités (icone ☆)
L'entrée en division des cellules est contrôlée par un jeu de protéines kinases et de protéines phosphatases. L'activation de la protéine kinase Greatwall est requise pour l'entrée en division et son inactivation pour la sortie de la mitose. L'équipe d'Anna Castro et Thierry Lorca au Centre de recherche en biologie cellulaire de Montpellier, dévoile le mécanisme en deux étapes, inconnu jusqu'à présent, qui conduit à l'inactivation complète de Greatwall. Cette étude est publiée dans la revue Journal of Cell Science.
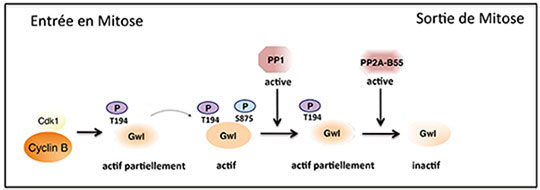
Figure: La protéine kinase Cdk1-Cycline B phosphoryle la protéine kinase Greatwall sur un résidu activateur (T194). Greatwall acquiert ainsi une activation partielle nécessaire pour s'auto phosphoryler sur un second site activateur (S875). L'inactivation de la protéine kinase Greatwall (Gwl) est essentielle pour une sortie correcte de la mitose. La protéine phosphatase 1 (PP1) déphosphoryle Greatwall au niveau du site S875, ce qui entraine une diminution de son activité. Ceci permet la réactivation de la phosphatase PP2A-B55 qui va poursuivre la déphosphorylation de Greatwall au niveau du second site activateur (T194) et d'autres substrats mitotiques.
© Thierry Lorca
La division cellulaire ou mitose est régulée par une activation coordonnée entre protéines kinases et protéines phosphatases qui ensemble activent de manière séquentielle les différentes voies de signalisation permettant l'entrée, la progression et la sortie de mitose. L'étape limitante repose sur l'activation de la kinase mitotique Cdk1-Cycline B. Toutefois, ce modèle a évolué très récemment grâce à de nouveaux résultats démontrant qu'outre le complexe Cdk1-Cycline B, la protéine kinase Greatwall est nécessaire pour entrer et progresser en mitose. Ce nouveau concept propose que l'entrée en mitose est basée sur l'activation de deux protéines kinases, l'une, Cdk1-Cycline B, impliquée dans la phosphorylation de nombreux régulateurs mitotiques requis pour l'entrée en mitose, l'autre, Greatwall, chargée d'inhiber la phosphatase PP2A-B55 qui déphosphoryle ces mêmes régulateurs.
La protéine kinase Greatwall est activée par phosphorylation lors de l'entrée en mitose et son inactivation par déphosphorylation est requise pour une sortie correcte de la division Toutefois, les mécanismes moléculaires mis en jeu lors de cette inactivation restaient encore inconnus. L'équipe d'Anna Castro et Thierry Lorca montre que la protéine Phosphatase 1 (PP1) joue un role crucial dans la déphosphorylation de Greatwall au niveau d'un acide aminé activateur, la sérine 875. L'absence de PP1 empêche la sortie de mitose en maintenant Greatwall sous sa forme active. La déphosphorylation du site S875 réduit l'activité de la kinase Greatwall, ce qui entraine une réactivation partielle de la phosphatase PP2A-B55. Celle-ci va à son tour déphosphoryler Greatwall au niveau d'un second site régulateur, la théonine 194. Greatwall est alors totalement inactivée, ce qui permet la déphosphorylation de nombreux autres substrats mitotiques par la protéine phosphatase PP2A-B55 et la réalisation d'une mitose correcte.
Populaires