Restez toujours informé: suivez-nous sur Google Actualités (icone ☆)
L'analyse des structures tridimensionnelles des ribosomes des trois grands phylums du vivant par des chercheurs de l'Institut de microbiologie de la Méditerranée, montre que les protéines ribosomiques communiquent entre-elles par des extensions qui forment un réseau étrangement similaire aux réseaux de neurones des "cerveaux" d'organismes simples. L'organisation de ce réseau qui interconnecte les sites fonctionnels distants du ribosome, suggère qu'il pourrait transférer et traiter le flux d'information qui circule entre eux pour coordonner par des "synapses moléculaires" les tâches complexes associées à la biosynthèse des protéines. Cette étude est publiée dans la revue Scientific Reports.
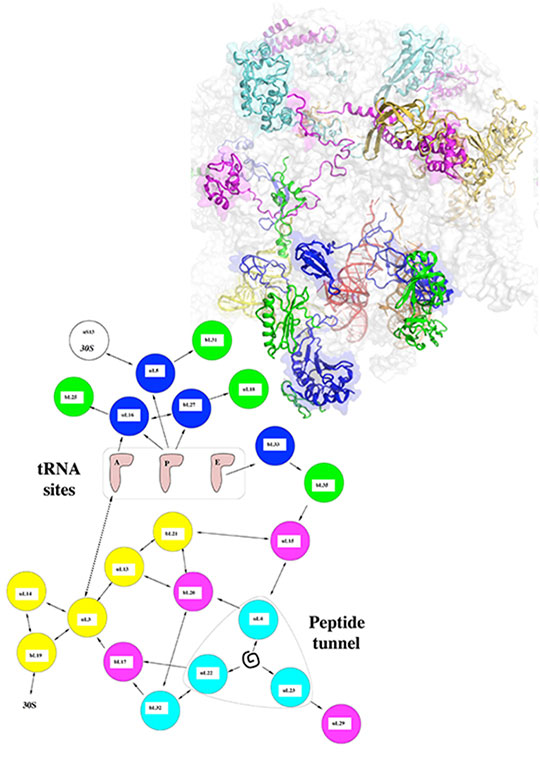
Figure: Communication entre les sites fonctionnels de la grande sous-unité du ribosome bactérien. En haut, la structure de la sous-unité 50S. Pour mettre en évidence les protéines, l'ARN ribosomique est représenté par une surface translucide. En bas: représentation schématique du réseau d'interactions entre les protéines représentées par des flèches. Dans les deux figures, les protéines sont coloriées en fonction de leur statut dans le réseau ; bleu foncé: les protéines qui innervent les sites de fixation des ARN de transfert, bleu clair: les protéines qui testent la sortie du peptide synthétisé au cours de la traduction. Les autres protéines interconnectent les sites fonctionnels et permettent le transfert d'information dans le ribosome. Une organisation similaire est observée dans la petite sous-unité du ribosome (30S) qui fixe l'ARN messager.
© Youri Timsit
Le ribosome, organite cellulaire formé d'ARN et de protéines, assure la traduction du code génétique dans les cellules: il réunit les ARN de transfert aminoacylés le long de l'ARN messager, pour fabriquer une protéine dont la séquence est dictée par celle de l'ARN messager. Ce processus constitue une véritable chorégraphie dans laquelle la fixation de nombreux acteurs moléculaires (substrats, facteurs de traduction) s'accompagne de mouvements complexes coordonnés dans le temps et l'espace.
La résolution de la structure des ribosomes d'archées et de bactéries par cristallographie aux rayons X a permis d'observer ces mécanismes à l'échelle moléculaire. Elle a aussi mis en lumière le mode d'action des antibiotiques les plus courants et surtout ouvert une fenêtre sur les origines de la Vie. En effet, le ribosome est universel et a évolué par accrétion. Ces découvertes ont valu le prix Nobel de chimie 2009 à T. Steitz, V. Ramakrishnan et A. Yonath. Peu de temps après, Marat Yusupov à l'Institut de Génétique et de Biologie Moléculaire et Cellulaire à Strasbourg, a réalisé l'exploit considérable de résoudre la structure à haute résolution d'un ribosome eukaryote, beaucoup plus gros et plus complexe. Cependant, dans ces structures vertigineuses, il restait encore un mystère à élucider: pourquoi les protéines ribosomiques ont-elles de si longues extensions filamenteuses qui se faufilent entres les groupements phosphates du labyrinthe de l'ARN ribosomique ? On a longtemps pensé que ces extensions, très chargées positivement (riches en arginines et lysines), servaient à neutraliser les charges négatives de l'ARN et à aider son repliement en 3D.
En analysant l'ensemble de ces données cristallographiques, les chercheurs marseillais proposent une explication tout à fait différente. Ils montrent que ces extensions radient dans tout le ribosome pour former un vaste réseau qui interconnecte les protéines ribosomiques entre-elles. Celles-ci interagissent par des interfaces très particulières et très conservées au cours de l'évolution. Cependant, ces zones de contact sont bien plus petites que les zones de contact observées habituellement entre les protéines destinées à stabiliser leurs interactions. Ici, elles sont limitées à quelques acides aminés et sont caractérisées par un type d'interaction très particulier (interactions entre acides aminés basiques et aromatiques) que l'on retrouve justement entre de nombreux neuromédiateurs et récepteurs dans le cerveau. Ces zones de contact évoquent des "synapses moléculaires" qui permettraient la transmission d'une information d'une protéine à l'autre. Il est à noter que l'établissement de la structure cristallographique de la protéine ribosomique bL20 d'une bactérie thermophile, avait déjà montré qu'une information structurale pouvait se propager le long de sa longue extension en hélice, d'une extrémité à l'autre de la protéine.
En outre, ce réseau présente une analogie frappante avec des réseaux de neurones ou avec le cerveau d'organismes simples comme C. elegans qui ne comporte que quelques dizaines de neurones. Comme les neurones, les protéines ribosomiques se répartissent en protéines "sensorielles" qui innervent les sites fonctionnels distants à l'intérieur du ribosome (sites de fixation des tRNAs, des facteurs de traductions et sites qui canalisent la sortie de la protéine synthétisée) et les "inter-protéines" qui établissent des ponts entre-elles. Cette organisation suggère que ce réseau forme une sorte de "cerveau moléculaire" permettant d'échanger et de traiter le flux d'information traversant le ribosome, pour coordonner les différentes étapes et les mouvements complexes pendant la traduction (voir Figure).
Le concept de "cerveau moléculaire" fait faire un grand saut d'échelle dans les propriétés du vivant et en particulier ses systèmes de traitement de l'information. Il ouvre de nouvelles perspectives tant en biologie fondamentale qu'en nanotechnologie.
Il reste maintenant à élucider la nature des signaux échangés entre les protéines et les mécanismes "allostériques" qui permettent la communication et le traitement de l'information au sein de ces réseaux.
Populaires