Restez toujours informé: suivez-nous sur Google Actualités (icone ☆)
Une équipe de chercheurs de l'Institut National des Sciences et des Techniques Industrielles Avancées (AIST), dirigée par SUZUKI Toshio et associée à l'équipe du Professeur Nigel SAMMES de l'Ecole des Mines du Colorado (Etats-Unis), a développé une micro-pile à combustible à oxyde solide qui peut fonctionner à 450°C.
Une pile à combustible est un appareil qui produit de l'électricité par réaction entre l'hydrogène et l'oxygène. L'oxygène provient de l'air ambiant, alors que suivant les modèles, l'hydrogène est soit injecté directement dans la pile, soit produit par celle-ci à partir d'hydrocarbures (le plus souvent du méthane) ou d'alcools (méthanol). L'avantage d'utiliser des hydrocarbures comme combustibles est qu'ils sont moins coûteux à produire et à stocker que l'hydrogène.
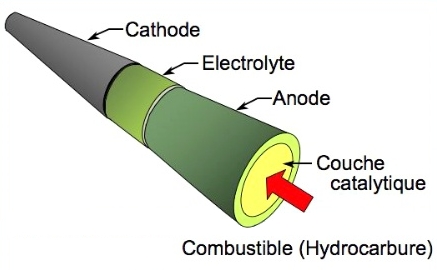
Structure de la pile à combustible
Les piles à combustible à oxyde solide sont constituées entièrement de céramiques. Elles peuvent fonctionner avec du dihydrogène pur ou des hydrocarbures. Du fait de leur température de fonctionnement très élevée (entre 700°C et 1000°C), elles ne sont actuellement utilisées que dans des installations de grande taille, donc fixes. Pour pouvoir les utiliser dans des unités plus réduites (pour des véhicules ou des résidences individuelles), il est nécessaire d'abaisser cette température de fonctionnement pour ainsi accélérer leur démarrage et réduire leur consommation d'énergie (et donc d'augmenter leurs rendements).
Une pile à combustible à oxyde solide est constituée de deux électrodes séparées par une membrane solide qui permet le passage des ions O2- de la cathode vers l'anode. Les réactions mises en jeu sont 2H2 -> 4H+ + 4e- au niveau de l'anode et 4e- + O2 -> 2O2- au niveau de la cathode. Le combustible est reformé sous l'action de catalyseur. Dans le cas du méthane, la réaction est: CH4 + 2H2O -> 4H2 + CO2.
La micro-pile que l'équipe de l'AIST a créée a la forme d'un tube. Elle n'est donc pas plate, comme c'est le cas habituellement. Ceci permet d'appliquer la couche de catalyseur directement sur la surface de l'anode, le courant étant collecté aux extrémités du tube. Avec une pile classique, la couche qui collecte le courant est appliquée à la surface des électrodes, séparant ainsi la couche de catalyseur de l'anode. Cette nouvelle structure permet de reformer le combustible directement à la surface de l'anode.
Plus précisément, la micro-pile est constituée d'un emboîtement de trois tubes: la partie extérieure, à base d'oxyde de cérium (CeO2), de lanthane (La) et de cobalt (Co), constitue la cathode. La partie intéreure, à base de nickel (Ni) et d'oxyde de cérium, constitue l'anode. La partie entre les deux, à base d'oxyde de cérium, constitue l'électrolyte. La surface intérieure de l'anode est enduite d'une couche de quelques micromètres d'épaisseur d'oxyde de cérium, qui constitue la couche catalytique. Le diamètre de l'ensemble mesure 1,8 mm. Le combustible (un mélange de méthane et de vapeur d'eau) circule à l'intérieur du tube.
Les tests effectués par les chercheurs ont permis d'obtenir, à 450°C, une tension de sortie de 0,9V et une densité de puissance de 0,1 W/cm2. Avec des cellules qui ne disposent pas de couche catalytique, la tension tombe à 0,6 V et la densité de puissance à quelques mW/cm2.
L'équipe continue ses recherches dans l'intention de trouver d'autres d'autres catalyseurs qui permettraient de diversifier les hydrocarbures utilisés comme combustibles et donc d'augmenter les rendements. Ils pensent ainsi pouvoir développer des piles pour des systèmes portables.
Populaires