Restez toujours informé: suivez-nous sur Google Actualités (icone ☆)
Comment les protéines ribosomiques participent-elles à la formation et à la stabilisation de la structure biologiquement active du ribosome ? Pour étudier cette question, des chercheurs du Laboratoire de Nanobiophysique de l'unité Gulliver (CNRS/ ESPCI) et du Laboratoire d'Expression Génétique Microbienne (CNRS) se sont focalisés sur la protéine ribosomique L20 d'Escherichia coli. Ils ont étiré à l'aide de pièges optiques des molécules individuelles d'ARN et ont observé l'interaction avec la protéine L20. L'utilisation de cette technique montre de manière directe que la protéine agit comme une pince stabilisant la structure de ses sites de liaison à l'ARN, qui constituent le coeur du fonctionnement du ribosome. Les chercheurs ont publiés ce travail dans les Proceedings of the National Academy of Sciences of the U.S.A.
Le ribosome est une magnifique machine moléculaire responsable de la traduction de l'ARN messager, c'est à dire de la synthèse des protéines. Chez E. coli, il est constitué de trois molécules d'ARN et de cinquante quatre protéines ribosomiques. L'ARN ribosomique (ARNr) est l'acteur principal de la traduction. Dans le ribosome, l'ARNr adopte une structure bien définie qui est indispensable à son activité biologique. Cette structure est très bien connue aujourd'hui, mais le rôle des protéines ribosomiques dans l'assemblage du ribosome et dans sa stabilisation reste mal comprise.
Pour répondre à cette question, les chercheurs ont tout d'abord démontré qu'en utilisant la technique des pinces optiques, ils pouvaient dérouler et étirer des structures d'ARN insérées dans une construction moléculaire tendue entre deux billes (voir Fig.1 et l'insert de la Fig.2).
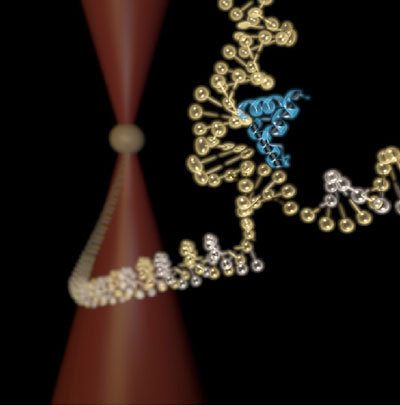
Figure 1: Vue d'artiste de l'expérience. On voit au premier plan la partie C-terminale de la protéine L20 (bleu) qui pince la molécule d'ARN (or). L'ARN forme une double hélice avec des brins d'ADN (argent), les hélices ainsi formées sont liées à des billes. Une bille tenue dans un piège optique est visible à l'arrière-plan.
© Pierre Mageol
Les chercheurs ont ensuite réitéré l'étirement des fragments d'ARN, cette fois-ci en présence de la protéine L20. En mesurant la force en fonction de l'étirement, ils ont constaté que la protéine rend un fragment d'ARN plus difficile à étirer, donc mécaniquement plus stable (Fig.2). Ce fragment d'ARN correspond à celui comportant le site de reconnaissance de la protéine. Par la même occasion, les chercheurs ont pu localiser ce site avec une précision de l'ordre du nucléotide.
Ce travail montre directement que la protéine L20 agit comme une pince, stabilisant la structure de son site de liaison à l'ARN ; en revanche, L20 est incapable d'accélérer la formation de ce site si celui-ci n'est pas initialement présent. En résumé, sur cet exemple de l'interaction L20-ARN, les chercheurs ont démontré que l'étirement d'un fragment d'ARN permet de dire où et avec quelle affinité il interagit spécifiquement avec une protéine. Aucune autre technique ne peut donner cette double information. Ces résultats présentent un intérêt général pour la biologie (assemblage du ribosome et régulation de la traduction) et la physique (physique statistique et mesures de force sur molécule unique).
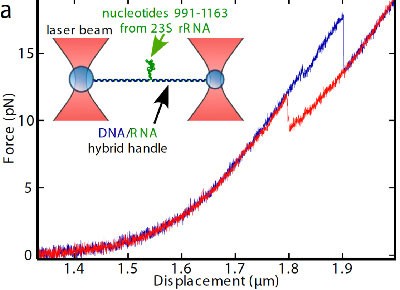
Figure2: Etirement d'un fragment de 173 nucléotides provenant de l'ARN 23S et contenant le site de fixation de L20. Le graphe montre la relation entre force et déplacement en absence (rouge) et en présence (bleu) de la protéine L20. Les chutes de force correspondent au dépliement de la structure d'ARN. On voit que le fragment s'ouvre à une force plus grande en présence de L20. Insert: schéma de l'expérience.
©PNAS
Ces travaux ont été menés dans le cadre de la thèse que Pierre Mangeol a préparé au Laboratoire de Nanobiophysique dirigé par Ulrich Bockelmann.
Le Laboratoire de Nanobiophysique étudie les propriétés physiques des acides nucléiques ADN et ARN, sur les principes physiques de l'activité des protéines qui manipulent les acides nucléiques et sur de nouvelles approches pour extraire l'information génétique de l'ADN. L'Unité "Expression Génétique Microbienne", dirigée par Marc Dreyfus, se consacre à l'étude fondamentale de l'expression génétique des micro-organismes, particulièrement E. coli, Bacillus subtilis, et Saccharomyces cerevisiae.
La protéine L20 reconnaît spécifiquement d'une part l'ARN ribosomique 23S et d'autre part son propre ARN messager
Les pinces optiques sont des outils qui utilisent des faisceaux laser pour maintenir et déplacer physiquement des objets diélectriques (qui ne conduisent pas le courant électrique) comme des billes de plastique ou des cellules biologiques.
Référence:
P. Mangeol, T. Bizebard, C. Chiaruttini, M. Dreyfus, M. Springer and U. Bockelmann
Probing ribosomal protein-RNA interactions with an external force
Proc. Natl. Acad. Sci. 108, 18272, 24 octobre 2011, (doi: 10.1073/pnas.1107121108
Populaires