Acide chlorhydrique - Définition
La liste des auteurs de cet article est disponible ici.
Chimie
Le chlorure d'hydrogène (HCl(g)) est un monoacide, qui se dissocie (s'ionise) pour donner un ion H+ (un proton). L'autre ion formé lors de la dissociation est l'ion chlorure Cl-. En solution aqueuse, l'ion H+ se lie à une molécule d'eau pour former un ion oxonium H3O+.
L'acide chlorhydrique peut donc être utilisé pour préparer des sels dits chlorures, comme par exemple le chlorure de sodium NaCl(s). L'acide chlorhydrique est un acide fort : il est totalement dissocié dans l'eau.
Les monoacides possèdent une seule constante de dissociation acide, Ka, qui est liée au taux de dissociation de l'acide dans l'eau. Pour un acide fort comme HCl, le Ka est très élevé (>1). Des tentatives ont été faites pour assigner une constante Ka à HCl. Lorsqu'un sel de chlorure comme NaCl(s) est ajouté à HCl aqueux, il n'a pratiquement aucun effet sur le pH, ce qui indique que l'ion Cl- est une base conjuguée extrêmement faible et que HCl est totalement dissocié en solution aqueuse. Pour des solutions d'acide chlorhydrique concentrées ou intermédiaires, l'hypothèse que la molarité des ions H+ est égale à la molarité d'HCl est excellente, avec un accord de quatre chiffres significatifs.
Parmi les acides forts courants en chimie, tous inorganiques, l'acide chlorhydrique est le monoacide le moins susceptible de subir une réaction parasite d'oxydo-réduction. Il est l'un des acides les moins dangereux à manipuler : en dépit de son acidité, il produit des ions chlorure très peu réactifs et non toxiques. Les solutions d'acide chlorhydrique moyennement concentrées sont stables et leur concentration ne varie pas dans le temps. Ces propriétés, alliées au fait qu'il est disponible comme réactif pur, font de l'acide chlorhydrique un très bon réactif acide ou un très bon acide pour le titrage de solutions basiques de concentrations inconnues. Les acides forts sont utiles pour le titrage parce qu'ils donnent des points d'équivalence plus marqués, rendant les résultats plus précis. L'acide chlorhydrique est fréquemment utilisé en analyse chimique ou pour dissoudre des échantillons en vue d'analyse. Les solutions d'acide chlorhydrique concentrées peuvent dissoudre certains métaux en formant des chlorures d'oxydes métalliques et du dihydrogène gazeux. Il est également utilisé comme catalyseur acide dans certaines réactions chimiques.
Propriétés physiques
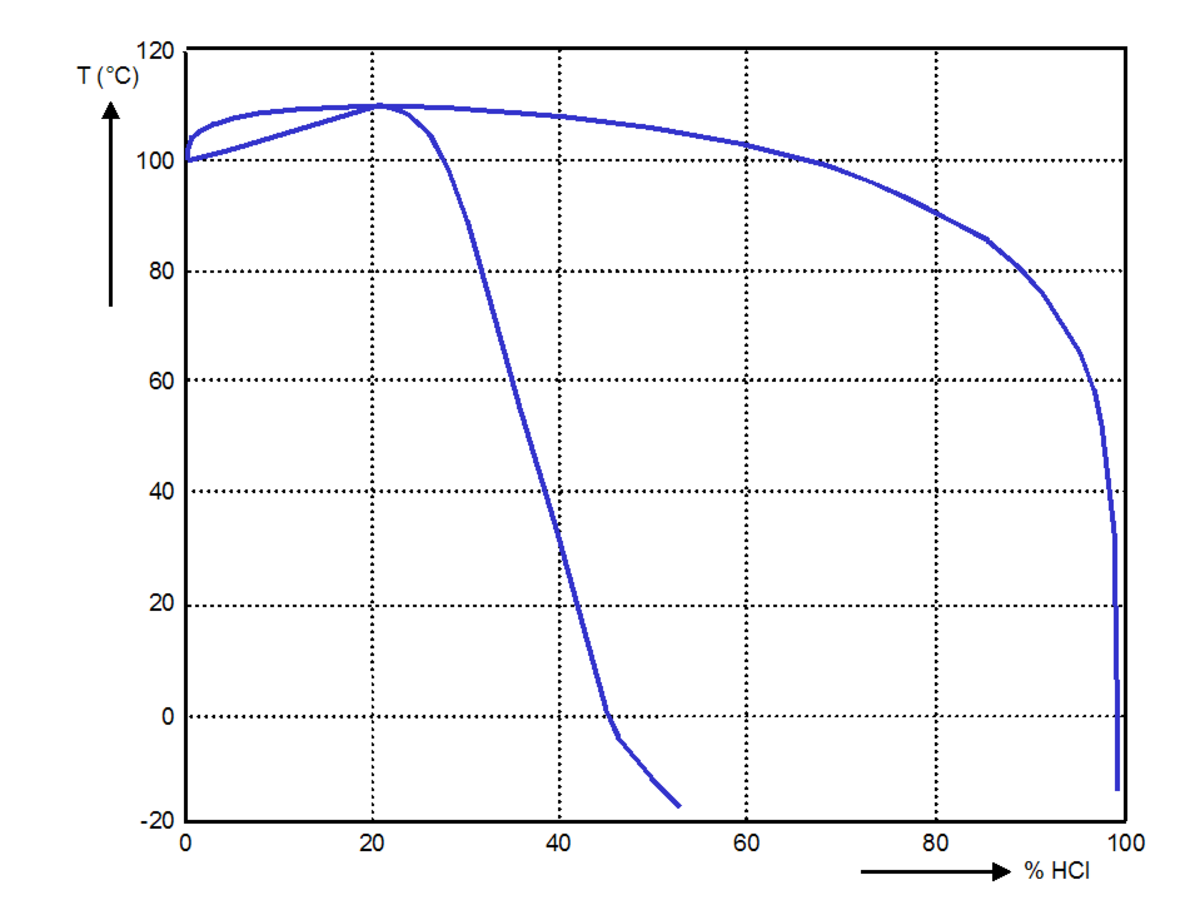
Les propriétés physiques de l'acide chlorhydrique, telles que les points d'ébullition ou de fusion, dépendent de la concentration ou de la molarité d'HCl en solution aqueuse. Elles varient depuis les propriétés physiques de l'eau pour 0 % de HCl jusqu'à celles de l'acide chlorhydrique fumant pour des fractions supérieures à 40 % de HCl.
| Pourcentage massique (%) | Concentration massique (kg·m-3) | Masse volumique (kg/L) | Molarité | pH | Viscosité (mPa·s) | Chaleur spécifique (kJ·kg-1·K-1) | Pression de vapeur (Pa) | Point d'ébullition (°C) | Point de fusion (°C) |
|---|---|---|---|---|---|---|---|---|---|
| 10 | 104,80 | 1,048 | 2,87 M | -0,5 | 1,16 | 3,47 | 0,527 | 103 | -18 |
| 20 | 219,60 | 1,098 | 6,02 M | -0,8 | 1,37 | 2,99 | 27,300 | 108 | -59 |
| 30 | 344,70 | 1,149 | 9,45 M | -1,0 | 1,70 | 2,60 | 1,410 | 90 | -52 |
| 32 | 370,88 | 1,159 | 10,17 M | -1,0 | 1,80 | 2,55 | 3,130 | 84 | -43 |
| 34 | 397,46 | 1,169 | 10,90 M | -1,0 | 1,90 | 2,50 | 6,733 | 71 | -36 |
| 36 | 424,44 | 1,179 | 11,64 M | -1,1 | 1,99 | 2,46 | 14,100 | 61 | -30 |
| 38 | 451,82 | 1,189 | 12,39 M | -1,1 | 2,10 | 2,43 | 28,000 | 48 | -26 |
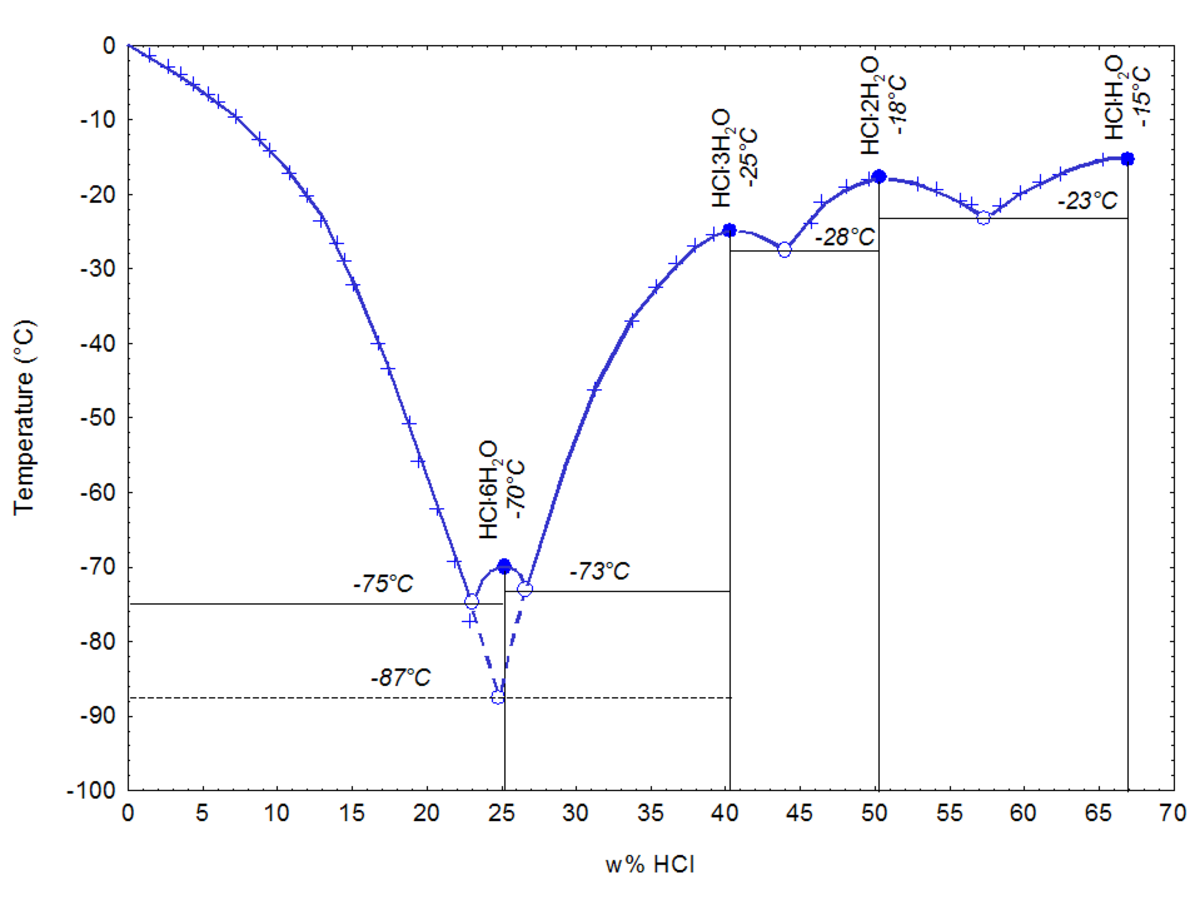
L'acide chlorhydrique en tant que mélange binaire de HCl et H2O possède un azéotrope en ébullition à 108,6 °C pour une fraction de 20,2 % HCl. En cristallisation, il possède quatre eutectiques pour former les cristaux de HCl·H2O (68 % HCl), HCl·2H2O (51 % HCl), HCl·3H2O (41 % HCl) et HCl·6H2O (25 % HCl) et de glace (0% HCl).