Sodium - Définition
La liste des auteurs de cet article est disponible ici.
Histoire
Le sodium est depuis longtemps reconnu dans les composés, mais il ne fut pas isolé avant 1807, lorsque Sir Humphry Davy réalisa l'électrolyse de la soude caustique. Pendant le Moyen Âge, un composé du sodium avec le nom latin de sodanum était utilisé pour le traitement des maux de tête. Le symbole du sodium Na vient du nom latin d'un composé du sodium appelé natrium, qui lui-même vient du grec nitron, une sorte de sel naturel (le natron). En allemand comme en néerlandais, sodium se dit Natrium.
Utilisations du sodium
Le sodium sous sa forme métallique est utilisé dans la fabrication des esters ainsi que dans celle d'autres composés organiques, utilisés en particulier dans l'industrie pharmaceutique, les cosmétiques, les pesticides, etc.
Il a été longtemps utilisé, sous forme d'alliage avec le plomb, pour la production de plomb tétraéthyle, additif antidétonant pour le carburant automobile.
Autres utilisations du sodium métal :
- pour la synthèse de l'indigo artificiel, du borohydrure de sodium, dans la réduction de Birch
- dans certains alliages, pour améliorer leur structure ;
- pour purifier les métaux fondus ;
- pour la fabrication du silicium utilisé dans l'électronique ou les panneaux solaires ;
- pour les batteries sodium - soufre ;
- le sodium sous forme liquide constitue un efficace fluide caloporteur (assurant le transfert de chaleur) : on l'utilise dans ce but principalement dans les soupapes (creuses) de moteurs poussés, mais il sert également dans les réacteurs nucléaires à neutrons rapides.
Le NaK est un alliage de sodium et de potassium, c'est un matériau important pour les transferts thermiques.
Le sodium est utilisé sous forme de vapeur alcaline dans les lampes à vapeur de sodium. Cette vapeur est très réactive : par exemple, à 1 400 °C, elle réagit avec l'alumine en formant de l'aluminate.
Caractéristiques notables
Comme les autres métaux alcalins, le sodium a un aspect doux, blanc argenté, légèrement rosé. C'est un élément très réactif ; en particulier il s'oxyde lentement à l'air humide et réagit violemment avec l'eau, ce qui force à le conserver dans le pétrole ou sous une atmosphère inerte d'azote ou d'argon. Le sodium est léger, flotte sur l'eau et la décompose en libérant du dihydrogène et en formant de la soude, l'hydroxyde de sodium.
La chaleur dégagée par la réaction exothermique de décomposition de l'eau suffit généralement, en présence d'oxygène, à faire détoner l'hydrogène produit.
Sa température de fusion relativement basse, aux alentours de 97,81 °C, le rend facile à manipuler, stocker et transporter (en citernes par exemple, dans lesquelles on le solidifie pour le refondre à l'arrivée), à condition d'être très vigilant à bien le laisser toujours sous atmosphère inerte et à l'abri de l'eau ou de l'humidité, en raison de sa grande réactivité.
Ce métal ne brûle dans l'air qu'à des températures supérieures à 388 K (soit 115 °C).
C'est un excellent conducteur électrique.
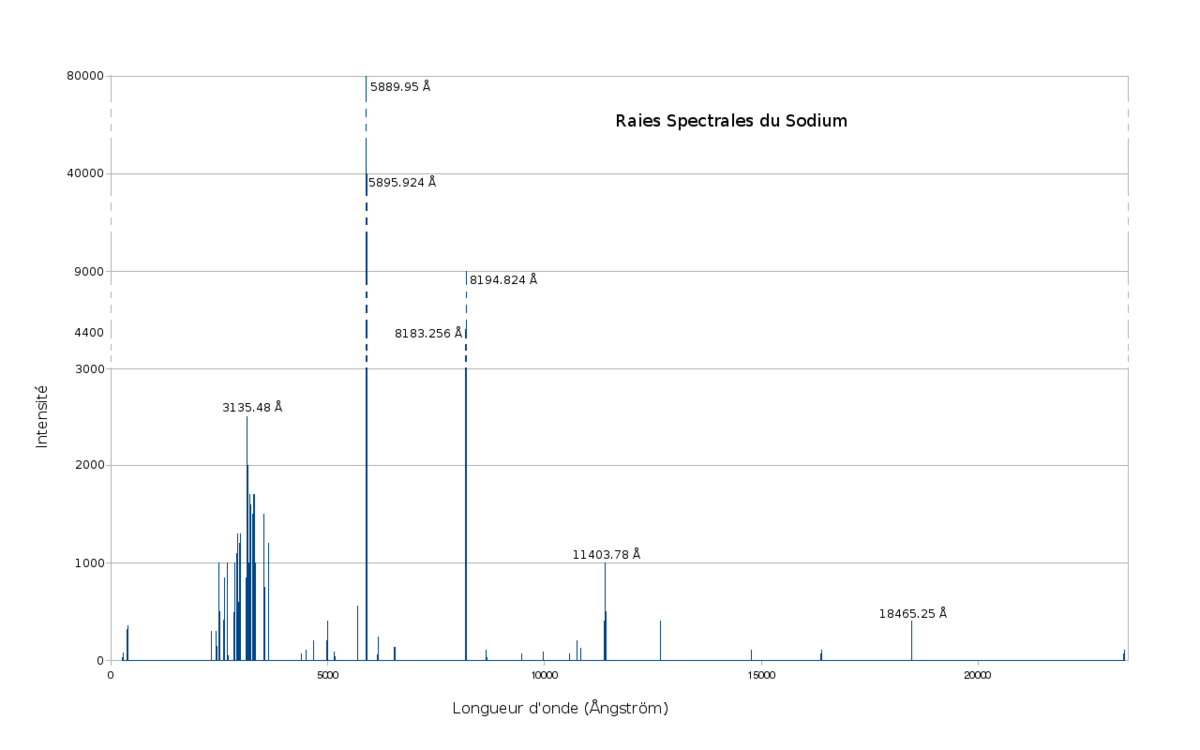
Le spectre du sodium possède la particularité de présenter un doublet spectral très brillant dans le jaune. Ces deux raies, localisées à 5890,0 et 5895,9 Ångströms sont généralement notées D1 et D2. Leur interférence est responsable d'un phénomène de battement en intensité.
À mesure que la pression augmente, le sodium devient isolant et prend l’aspect d’un matériau noir, puis celui d’un matériau translucide rouge avant de finalement devenir transparent sous une pression de 200 gigapascal.