Restez toujours informé: suivez-nous sur Google Actualités (icone ☆)
Le microARN-7a se trouve à l'origine de la régionalisation des cellules souches dans les parois ventriculaires du cerveau adulte. Sa présence dans les cellules souches latérales empêche l'expression d'une protéine essentielle à la fabrication des neurones dopaminergiques, laissant ainsi cette spécificité aux cellules souches dorsales. En modulant l'activité de ce microARN, il est alors envisageable de générer des neurones à dopamine pouvant remplacer ceux qui dégénèrent au cours de la maladie de Parkinson. Ces résultats prometteurs, obtenus par l'équipe d'Harold Cremer à l'Institut de biologie du développement de Marseille Luminy (IBDML, CNRS/Université Aix-Marseille), ont été publiés dans la revue Nature Neuroscience.
Deux régions du cerveau connaissent un renouvellement neuronal tout au long de la vie: le bulbe olfactif, impliqué dans l'olfaction, et l'hippocampe, impliqué dans la mémoire et l'apprentissage. Au cours de la neurogenèse olfactive, les cellules souches situées sur les parois des ventricules cérébraux génèrent différents types de neurones, qui migrent sur une longue distance pour coloniser le bulbe olfactif et jouent un rôle important dans la perception des odeurs. Cette diversité neuronale est due à l'existence d'une variété de cellules souches au destin prédéterminé. Les cellules souches de la paroi ventriculaire dorsale produisent par exemple des neurones libérant de la dopamine, alors que les cellules souches de la paroi latérale des ventricules génèrent des neurones à GABA, un neurotransmetteur inhibiteur bien connu.
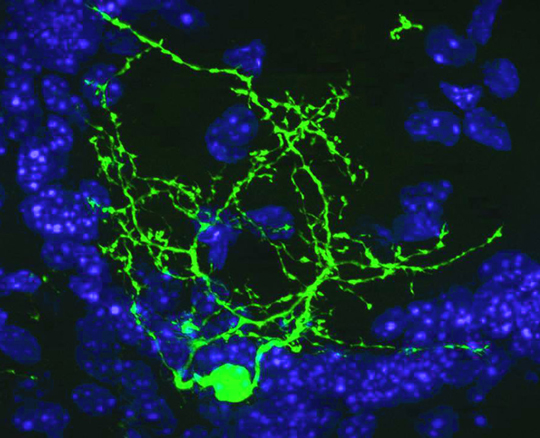
Figure: Visualisation par électroporation in vivo de neurones périglomérulaires dopaminergiques (en vert) dans le bulbe olfactif. © IBDML, Harold Cremer
Les chercheurs de l'IBDML ont étudié la régulation de cette régionalisation des cellules souches à l'échelle moléculaire. En travaillant sur des souriceaux, ils ont montré que l'expression de la protéine Pax6, essentielle à la production des neurones à dopamine, est restreinte aux cellules souches dorsales dans les parois ventriculaires. De manière très surprenante, ils ont observé que le gène Pax6 était pourtant transcrit dans les cellules souches des parois latérales, démontrant ainsi qu'une régulation post-transcriptionnelle vient se surimposer à la régulation transcriptionnelle classique afin d'empêcher la traduction de Pax6 en protéine active dans ces cellules.
Les scientifiques ont alors démontré que c'est un petit ARN non traduit, enrichi dans les cellules souches latérales et appelé "microARN-7a", qui permet la restriction de Pax6 dans les cellules souches dorsales, en se liant à l'ARN messager de Pax6 et en inhibant ainsi sa traduction en protéine dans les cellules latérales. Ce résultat a été obtenu en utilisant la technique d'électroporation in vivo, qui permet de faire entrer tout type de matériel génétique dans les cellules souches dorsales ou latérales, et des méthodes modernes de séquençage développées par la plate-forme transcriptomique de l'Institut de pharmacologie moléculaire et cellulaire (IPMC, CNRS/Université Nice Sophia Antipolis) dirigé par Pascal Barbry. Les chercheurs ont ensuite mis en évidence que le blocage génétique du microARN-7a dans les cellules souches latérales suffisait à y induire l'expression de Pax6 et à changer leur destin, en leur faisant produire des neurones à dopamine.
Cette régulation post-transcriptionnelle ajoute un niveau de complexité à la régionalisation des cellules souches dans le cerveau adulte et permet un réglage extrêmement fin de l'expression des gènes entre cellules voisines. Dans une perspective thérapeutique, il est très intéressant d'observer que la modulation d'un seul petit ARN non traduit suffit à augmenter la production de neurones dopaminergiques ayant un potentiel de remplacement cellulaire dans le contexte de la maladie de Parkinson. En effet, les neurones à dopamine olfactifs ne sont pas affectés chez les patients parkinsoniens et présentent des caractéristiques similaires aux neurones qui dégénèrent au fil de la maladie, comme la libération spontanée de dopamine. Ces neurones à dopamine pourraient donc être remplacés par leurs précurseurs des parois ventriculaires, dont le nombre peut largement être augmenté par inhibition du microARN-7a.
Populaires