Restez toujours informé: suivez-nous sur Google Actualités (icone ☆)
Afin de traiter et transmettre l'information au sein de réseaux, les neurones présentent une organisation polarisée qui dépend d'assemblages moléculaires formant des compartiments distincts au sein de la cellule. La microscopie optique de super-résolution ou "nanoscopie" permet d'observer directement ces assemblages à l'échelle nanométrique pour élucider leur fonction. Une équipe du Centre de recherche en neurobiologie et neurophysiologie de Marseille a utilisé la nanoscopie pour déterminer l'architecture moléculaire du segment initial de l'axone, un compartiment clé pour l'organisation et la communication des neurones. Ces travaux, publiés dans la revue Cell Reports, apportent des informations d'une précision inégalée sur l'organisation neuronale. Ils ouvrent la voie à une meilleure compréhension des phénomènes de polarité et de transport cellulaires qui sont profondément affectés dans les maladies neurodégénératives comme la maladie d'Alzheimer.
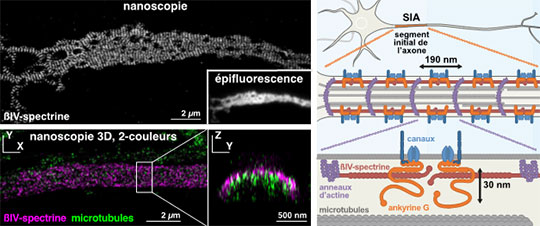
Figure: Image par nanoscopie d'un SIA marqué pour la ßIV-spectrine (en haut à gauche). L'organisation en bandes périodiques est clairement visible, contrairement à l'image de microscopie d'épifluorescence classique (encart) dont la résolution est trop limitée pour distinguer ces bandes. La nanoscopie peut être réalisée en 3D et en 2 couleurs (en bas à gauche), permettant de visualiser des coupes transverses du SIA, par exemple les microtubules à l'intérieur (en vert) entourés par la ßIV-spectrine sous-membranaire (en rose). A droite, schéma en zooms successifs montrant la localisation et l'organisation du SIA à l'échelle moléculaire, avec le complexe sous-membranaire périodique (190 nm) et l'extension de l'ankyrine G (32 nm).
© Christophe Leterrier
Les capacités du cerveau à stocker et traiter l'information reposent sur l'organisation en réseaux des milliards de neurones qui le constituent. Afin de former ces réseaux, les neurones doivent s'organiser de manière polarisée, avec une arborisation complexe composée de dendrites qui reçoivent l'information et d'un axone qui envoie les messages sous forme de potentiels d'action. L'un des grands sujets de recherche de la biologie cellulaire du neurone est de comprendre comment les neurones parviennent à établir et à maintenir cette organisation complexe par une myriade de mécanismes de transport et d'assemblage cellulaires. A l'entrée de l'axone, un compartiment clé permet de le séparer du reste du neurone et de générer les potentiels d'action: c'est le segment initial de l'axone (SIA). Il est constitué d'un assemblage unique de protéines d'échafaudage et de canaux ioniques, mais leur arrangement macromoléculaire était jusqu'à aujourd'hui énigmatique. Connaitre cet arrangement permettrait de comprendre comment le SIA peut gérer l'entrée des protéines dans l'axone, une étape importante pour le maintien de l'organisation neuronale.
Pour déterminer l'arrangement des protéines du SIA, les membres de l'équipe "Architecture des Domaines Axonaux" ont utilisé la microscopie optique de super-résolution (nanoscopie). Cette méthode, couronnée par le prix Nobel de Chimie 2014, permet de visualiser les assemblages protéiques au sein des cellules avec une résolution de l'ordre de 20 nanomètres, dix fois meilleure que la microscopie classique, Grâce à un partenariat avec Nikon Instruments, les chercheurs ont exploité cette technique pour cartographier les composants du SIA et leur arrangement à l'échelle moléculaire. La précision de la nanoscopie, couplée à l'utilisation de plusieurs anticorps contre différentes parties de protéines du SIA, a permis de déterminer la position et l'orientation de ces protéines. Les chercheurs ont confirmé que le complexe d'actine et de spectrine sous la surface du SIA est organisé de manière périodique, avec des paires de spectrines reliant des anneaux d'actine espacés de 190 nanomètres. Ils ont ensuite révélé que l'ankyrine G, la protéine d'échafaudage qui retient les canaux ioniques au SIA, a une extrémité insérée dans ce complexe périodique, tandis que l'autre dépasse vers l'intérieur de la cellule, avec une extension moyenne de 30 nanomètres.
Une fois cette cartographie moléculaire obtenue, ils ont testé la robustesse de cet assemblage en perturbant le cytosquelette neuronal ainsi que la signalisation intracellulaire. Ils ont démontré que le SIA est non seulement hautement organisé à l'échelle nanoscopique, mais que cette organisation est particulièrement résistante. Ces résultats suggèrent que l'organisation du SIA est importante pour maintenir et réguler le transport vers l'axone, permettant d'entretenir et de modifier l'arborisation axonale. Une meilleure compréhension de ce transport vers l'axone permettra d'appréhender comment et pourquoi il est profondément altéré dans les phases précoces des maladies neurodégénératives comme la maladie d'Alzheimer.
Populaires