Restez toujours informé: suivez-nous sur Google Actualités (icone ☆)
En immunothérapie du cancer, les études effectuées sur des modèles de tumeurs transplantées chez la souris aboutissent souvent à des résultats très prometteurs. Hélas, bien souvent, ces mêmes traitements sont en échec dans les carcinomes humains. Le même échec est observé dans des modèles murins de tumeurs spontanées. Pourquoi ? Un début d'explication vient d'être publié dans la revue Nature Communications. Les chercheurs montrent que le TGFb (molécule de mauvais pronostic abondante dans de nombreuses tumeurs humaines) est présent dans des tumeurs mammaires murines spontanées dans lesquelles il empêche l'action de traitements anticancéreux tandis qu'il est quasi-absent dans les tumeurs transplantées qui sont sensibles à ces traitements.
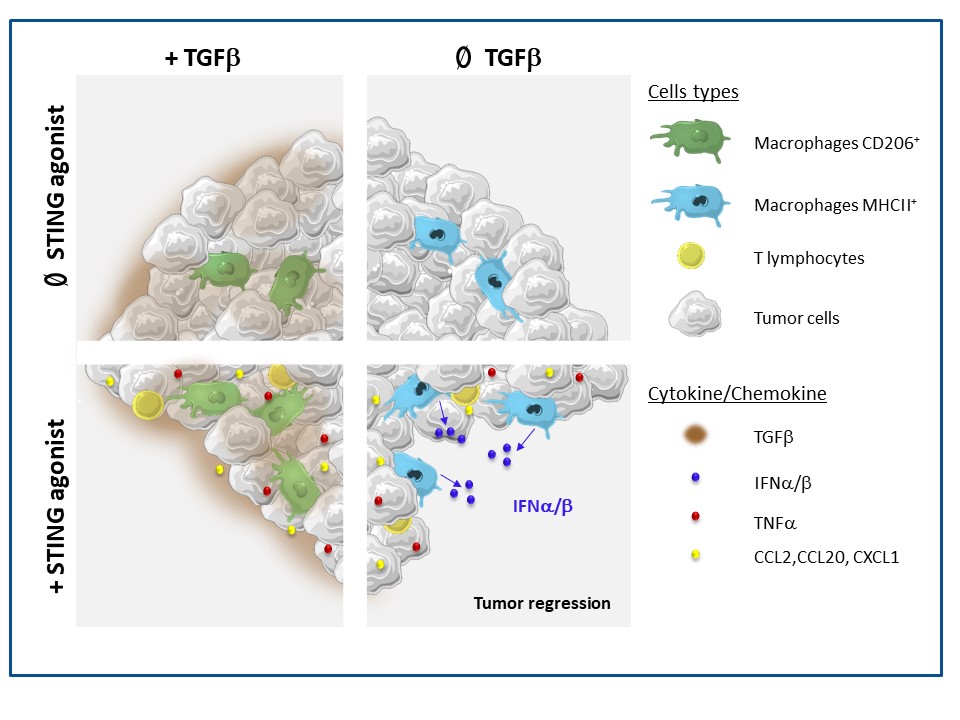
Figure: La présence de TGFb dans les tumeurs mammaires spontanées (en haut à gauche) polarise les macrophages vers un phénotype immunosuppresseur. Dans ces conditions, l'ajout d'un agoniste de STING (en bas à gauche) ne permet pas d'induire la production d'IFNa/b et par conséquent de régression tumorale. En présence d'un anti-TGFb (en haut à droite), les macrophages retrouvent un phénotype activé, ce qui permet, suite à l'ajout de l'agoniste de STING, la production d'IFNa/b et la régression de ces tumeurs.
© Marion Guerin & Nadège Bercovici
Les chercheurs avaient montré précédemment, dans un modèle murin de tumeurs transplantées, qu'en mimant une attaque virale avec un ligand de STING (récepteur impliqué dans la détection de microbes), on pouvait provoquer une très forte diminution de la masse tumorale. Dans ce modèle, les tumeurs étaient obtenues après injection de dizaines de milliers de cellules tumorales d'un coup. Les régressions tumorales déclenchées par le ligand de STING étaient associées à l'induction d'une production massive d'interférons a et b (IFNa/b) par les macrophages (Mφ) infiltrant les tumeurs. Les Mφ acquéraient ainsi une activité cytotoxique et alertaient des lymphocytes T tueurs afin qu'ils puissent amplifier cette attaque anti-tumorale. Ces résultats suggèrent que l'agoniste de STING met en jeu un arsenal antiviral permettant d'attaquer la tumeur.
Il existe par ailleurs un modèle murin où les tumeurs mammaires apparaissent plusieurs mois après la naissance de souris transgéniques exprimant plusieurs oncogènes. Cependant, ces tumeurs spontanées, qui auraient pu constituer un meilleur modèle pour les cancers du sein, se montrent quasiment insensibles au ligand de STING. Comment expliquer cette propriété ?
Le TGFb est une molécule produite par les Mφ indispensable au développement des tissus et à leur réparation, qu'ils soient embryonnaires ou tumoraux. Contrairement à ce qui est observé dans les tumeurs murines transplantées, le TGFb est très abondant dans les tumeurs spontanées et y favorise le processus de croissance tumorale. L'étude présentée ici démontre que le TGFb peut désactiver le système d'alerte antiviral en éteignant la voie STING-IFNa/b et permettant donc une croissance incontrôlée de la tumeur. En traitant les souris avec un anticorps anti-TGFb, les chercheurs ont montré qu'il était possible de réenclencher le système d'alerte STING-IFNa/b et ainsi de provoquer avec un ligand de STING une réponse anti-tumorale accompagnée d'une régression de tumeurs spontanées.
En s'appuyant sur ces résultats obtenus chez la souris, on pourrait inférer que des mécanismes similaires d'inhibition des IFNa/b dans les tumeurs humaines pourraient entraver l'efficacité des agonistes de STING (actuellement en cours d'essais cliniques). Le même antagonisme entre le TGFb et les IFNa/b pourrait expliquer des phénomènes de résistance aux anthracyclines, dont l'activité anti-tumorale met aussi en jeu la production d'IFNa/b dans la tumeur. Dans cette hypothèse, l'efficacité de nombreuses thérapies anti-tumorales (des anti-TGFb ou des inhibiteurs de sa signalisation sont d'ores et déjà disponibles) pourrait être renforcée par l'inactivation, au moins transitoire, du TGFb.
En savoir plus
TGFb blocks IFNa/b release and tumor rejection in spontaneous mammary tumors
Guerin MV, Regnier F, Feuillet F, Vimeux L, Weiss JM, Bismuth G, Altan-Bonnet G, Guilbert T, Thoreau M, Finisguerra V, Donnadieu E, Trautmann A, Bercovici N.
Nat Commun. 2019 Sept 11. doi: 10.1038/s41467-019-11998-w
Populaires