Restez toujours informé: suivez-nous sur Google Actualités (icone ☆)
Le glioblastome, une tumeur incurable du cerveau, est alimenté par un réservoir de cellules souches capables d'initier, maintenir et renouveler la tumeur. La cellule souche cancéreuse peut survivre en conditions hostiles notamment en atténuant les processus de dégradation intracellulaire médiée par les lysosomes. Cette étude publiée dans The EMBO Journal révèle que la protéase MALT1 agit comme un point de contrôle vie/mort des cellules souches cancéreuses en régulant la quantité de lysosomes.
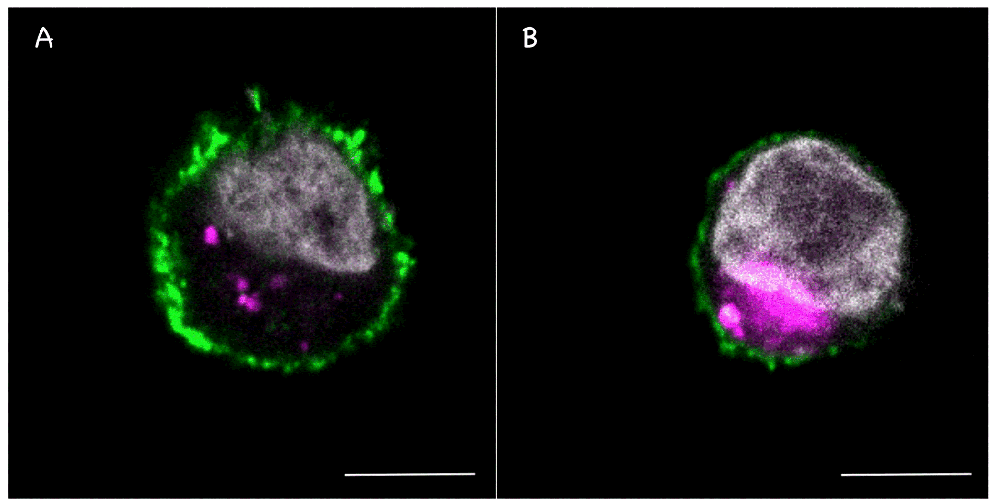
Figure: La forme sauvage (A) ou inactive (B) de l'arginine-protéase MALT1 a été introduite dans une cellule souche humaine de glioblastome. L'analyse en microscopie confocale permet de révéler les noyaux en gris, les lysosomes en magenta, et MALT1 en vert. Barre d'échelle: 10 mm.
© Julie Gavard
Les glioblastomes multiformes (GBM) sont des tumeurs du cerveau parmi les plus dévastatrices de l'adulte, avec une survie médiane de 15 mois après le diagnostic. Le traitement standard actuel comprend une résection neurochirurgicale suivie de cycles répétés de chimiothérapie et radiothérapie. Bien que ces stratégies standardisées se soient révélées bénéfiques, elles demeurent essentiellement palliatives. Au sein de ces tumeurs hautement hétérogènes, existe une sous-population de cellules tumorales appelées cellules de type souche du glioblastome (GSC). Bien que la définition moléculaire des GSCs fasse encore l'objet de débat, ces cellules jouent un rôle dans l'initiation et la progression de la tumeur, ainsi que dans les résistances thérapeutiques et la récurrence.
Les GSCs sont dispersées dans la tumeur à la fois à proximité des vaisseaux sanguins et à distance dans des zones moins oxygénées. Tandis que la vasculature cérébrale leur offre une "niche" protectrice, enrichie en facteurs de croissance, les GSCs sont également capables de supporter des conditions de privation extrême. Cette résilience est notamment liée à leur capacité à prolonger et maintenir des voies de signalisation de survie cellulaire, en l'absence des activateurs exogènes de la "niche". Cette caractéristique s'appuie sur la baisse du trafic d'endocytose des récepteurs membranaires aux facteurs de croissance et de leur dégradation dans les lysosomes qui sont des organites au pH acide fonctionnant comme des centres névralgiques pour le trafic et le métabolisme des macromolécules. Les lysosomes sont notamment impliqués dans la voie de signalisation multiple mTOR (mammalian Target of Rapamycin).
Afin d'identifier des régulateurs de cette voie intrinsèque d'autoprotection, les chercheurs ont analysé les bases de données publiques de plusieurs centaines de patients atteints de glioblastome. Parmi les gènes non déjà connus pour leur implication dans l'initiation de la transformation tumorale, ils ont observé une corrélation entre la survie des patients et l'expression du gène MALT1 (Mucosa-Associated lymphoid tissue Lymphoma Translocation protein 1). Ce gène spécifie la paracaspase MALT1, une arginine-protéase qui orchestre la réponse immunitaire lors de l'activation des lymphocytes, tandis qu'elle est constitutivement active dans certains lymphomes. Son rôle dans le système nerveux central et en particulier dans les glioblastomes n'a cependant pas été exploré en détail.
En utilisant des cellules isolées à partir des pièces opératoires de patients atteints de glioblastome, les chercheurs ont constaté que le blocage moléculaire de l'expression de MALT1 est toxique pour ces cellules. C'est aussi le cas lorsque MALT1 est inhibée pharmacologiquement par le biais d'antipsychotiques de la famille des phénothiazines, dont la mépazine. Ce frein à l'expansion tumorale est reproduit in vivo dans des souris greffées de tumeurs humaines.
Par des approches d'imagerie cellulaire, les chercheurs ont ensuite établi que l'activité protéolytique de MALT1 permet de maintenir des quantités faibles en lysosomes dans les GSCs. En revanche, le blocage de l'activité protéolytique de MALT1 ou la réduction de son expression provoque dans les GSCs un déferlement fatal en lysosomes. Ceci conduit à la mort cellulaire des GSCs, concomitante à une réduction de la voie de signalisation mTOR, normalement essentielle au maintien de leur caractère "souche".
La perturbation de l'homéostasie lysosomale pourrait donc représenter une nouvelle stratégie d'attaque contre les GSCs, faisant émerger MALT1 comme un "talon d'Achille" du glioblastome.
Pour en savoir plus:
Paracaspase MALT1 regulates glioma cell survival by controlling endo-lysosome homeostasis.
Jacobs KA, André-Grégoire G, Maghe C, Thys A, Li Y, Harford-Wright E, Trillet K, Douanne T, Alves Nicolau C, Frénel JS, Bidère N, Gavard J.
EMBO J. 2019 Nov 27:e102030. doi: 10.15252/embj.2019102030.
Populaires