🔬 Tollwutvirus: Wie kann ein so einfacher Virus eine menschliche Zelle dominieren?
Ein australisches Forscherteam hat den Schlüsselmechanismus identifiziert, den das Tollwutvirus nutzt. Ihre Arbeit, veröffentlicht in Nature Communications, zeigt, dass eines seiner Proteine, genannt P, eine zentrale Rolle spielt. Dieses Protein ist in der Lage, eine Vielzahl verschiedener Aufgaben zu erfüllen, um die Kontrolle über die Wirtszelle zu übernehmen, und bietet so eine Erklärung für die gefürchtete Effizienz des Virus trotz seines minimalen Genoms.
Der Schlüssel zu dieser Vielseitigkeit liegt in der Fähigkeit des P-Proteins, seine Form zu verändern und an RNA zu binden. RNA ist ein grundlegendes Molekül in unseren Zellen, verantwortlich für den Transport genetischer Informationen und die Regulation vieler Aktivitäten. Durch die Interaktion mit ihr kann das Virale Protein Zugang zu verschiedenen Zellkompartimenten erhalten und dort essentielle Prozesse orchestrieren, wie die Proteinproduktion oder die Immunantwort.
Diese Strategie wäre nicht exklusiv für das Tollwutvirus. Wissenschaftler glauben, dass andere sehr gefährliche Erreger, wie das Nipah- und das Ebola-Virus, einen ähnlichen Ansatz verfolgen könnten. Falls sich diese Hypothese bestätigt, würde dies den Weg für die Entwicklung innovativer Behandlungen ebnen, die darauf abzielen, diesen gemeinsamen Mechanismus zu blockieren und potenziell gegen mehrere Viruserkrankungen wirksam zu sein.
Die Entdeckungen dieser Studie stellen das traditionelle Modell multifunktionaler Proteine in Frage. Bisher stellte man sie sich wie Züge vor, bei denen jeder Waggon eine spezifische Funktion hatte. Nun zeigt sich, dass ihre Fähigkeiten auch aus der Art und Weise entstehen, wie ihre Teile interagieren und sich falten, um verschiedene Gesamtformen zu schaffen – eine Flexibilität, die es ihnen ermöglicht, neue Eigenschaften wie die RNA-Bindung zu erwerben.
Diese strukturelle Flexibilität ist die ultimative Waffe des Virus. Durch Formveränderung und Bindung an RNA kann das P-Protein zwischen verschiedenen physikalischen Phasen innerhalb der Zelle navigieren und in flüssige Bereiche eindringen, die Schlüsselfunktionen steuern (siehe Erklärung am Ende des Artikels). Diese Anpassung ermöglicht es ihm, die Zelle in eine hochproduktive Virusfabrik zu verwandeln und gleichzeitig ihre Abwehrkräfte zu neutralisieren.
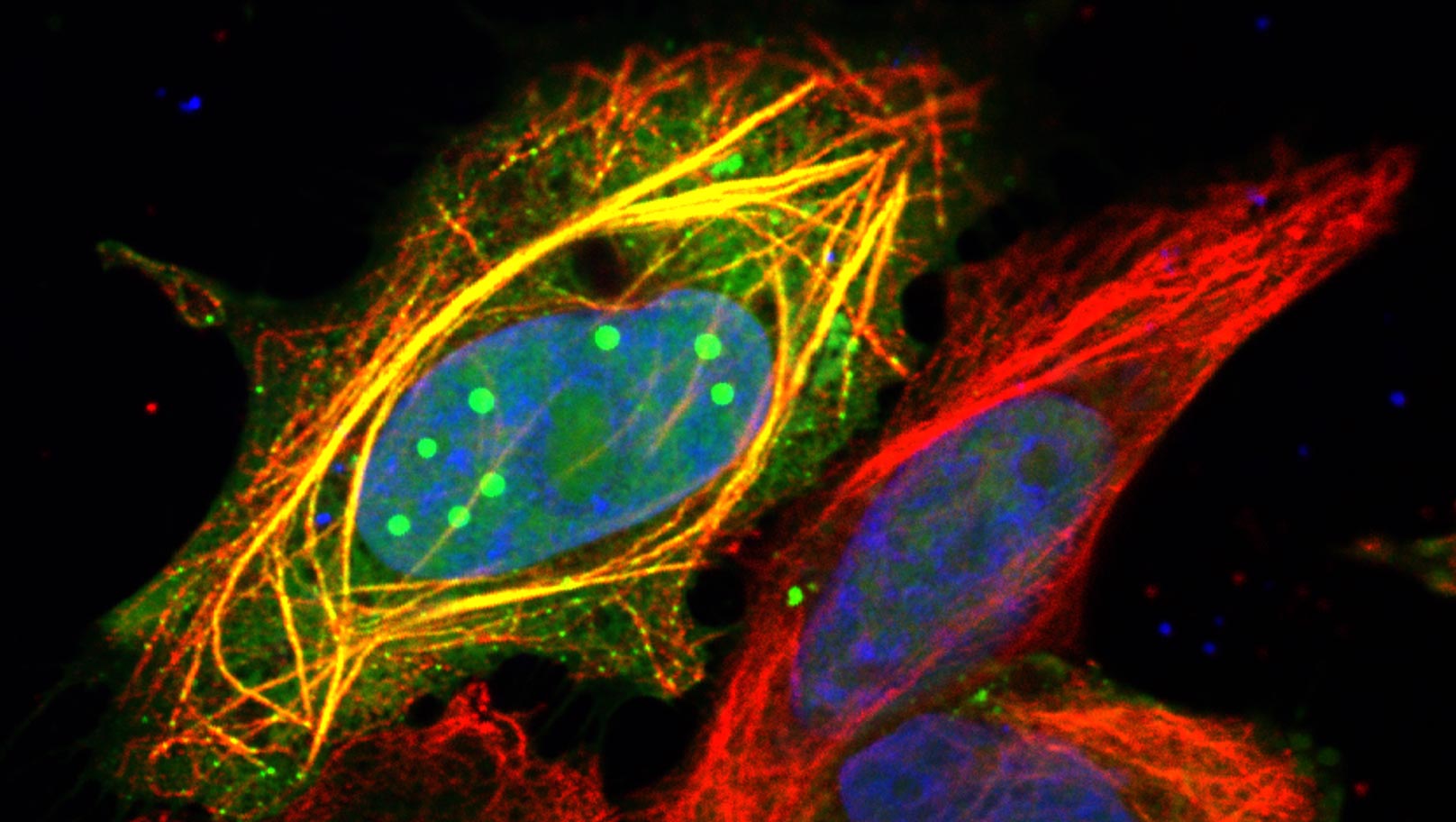
Konfokale Mikroskopie-Aufnahme menschlicher Zellen, die das P3-Protein des Tollwutvirus (grün) zeigt, das im Zellkern (blau) Tröpfchen bildet und an das Mikrotubuli-Netzwerk (rot) bindet.
Bildnachweis: Stephen Rawlinson, Monash University
Das Verständnis dieses neuen Mechanismus bietet vielversprechende Perspektiven für die Entwicklung von antiviralen Wirkstoffen oder Impfstoffen. Indem man die Fähigkeit des viralen Proteins, seine Form zu ändern oder mit RNA zu interagieren, anvisiert, könnte es möglich sein, seine Funktion zu stören und die Infektion zu verhindern. Dieser Fortschritt, Ergebnis einer Zusammenarbeit mehrerer australischer Institutionen, könnte somit unseren Ansatz zur Bekämpfung einiger der gefürchtetsten Virusinfektionen nachhaltig verändern.
Die Organisation in flüssigen Phasen innerhalb von Zellen
Zellen sind keine homogenen Säcke, sondern enthalten viele spezialisierte Kompartimente, von denen sich einige wie Flüssigkeiten verhalten. Diese biomolekularen Kondensate oder membranlosen Organellen entstehen durch einen Prozess namens flüssig-flüssig Phasentrennung. Spezifische Moleküle wie Proteine und RNA konzentrieren sich darin und schaffen so Mikroumgebungen, in denen wichtige biologische Reaktionen ablaufen.
Diese flüssigen Tröpfchen regulieren wesentliche Aktivitäten wie die Proteinherstellung in den Ribosomen, die RNA-Verarbeitung im Nukleolus oder die Reaktion auf zellulären Stress. Ihre Bildung und Auflösung ist dynamisch und ermöglicht der Zelle eine schnelle Anpassung an Veränderungen. Diese Organisation fördert die Effizienz von Prozessen, indem sie die benötigten molekularen Akteure zusammenbringt.
Viren haben sich entwickelt, um diese zelluläre Architektur auszunutzen. Durch Bindung an RNA und Formveränderung können virale Proteine wie das P-Protein der Tollwut in diese flüssigen Kompartimente eindringen. Einmal im Inneren, leiten sie deren Funktionen zur viralen Replikation um, indem sie beispielsweise die Produktion zellulärer Proteine stören oder Abwehrmechanismen umgehen.
Die Erforschung dieser Interaktionen eröffnet ein Forschungsfeld, um nicht nur Infektionen, sondern auch bestimmte Krankheiten zu verstehen, bei denen die Phasentrennung dereguliert ist, wie bei neurologischen Störungen. Durch das Zielen auf die Fähigkeit von Viren, diese Zonen zu infiltrieren, könnte man Medikamente entwickeln, die die Integrität der zellulären Kompartimente schützen und die Ausbreitung von Krankheitserregern begrenzen.