🦠 Erste Videoaufnahmen eines Virus, das in eine Zelle eindringt
Veröffentlicht von Cédric,
Artikelautor: Cédric DEPOND
Quelle: Proceedings of the National Academy of Sciences (PNAS)
Andere Sprachen: FR, EN, ES, PT
Artikelautor: Cédric DEPOND
Quelle: Proceedings of the National Academy of Sciences (PNAS)
Andere Sprachen: FR, EN, ES, PT
Die angewandte Methode, das Ergebnis einer internationalen Zusammenarbeit, kombiniert zwei mikroskopische Ansätze, um hochauflösende Bilder von lebenden Zellen zu erhalten. Sie zeigte, dass das Eindringen des Virus nicht auf eine einfache passive Kollision zurückzuführen ist. Stattdessen handelt es sich um eine dynamische und koordinierte Wechselwirkung zwischen dem Viruspartikel und der Membran seiner Zielzelle – einen Dialog, der der Invasion vorausgeht und ihren Erfolg bestimmt.
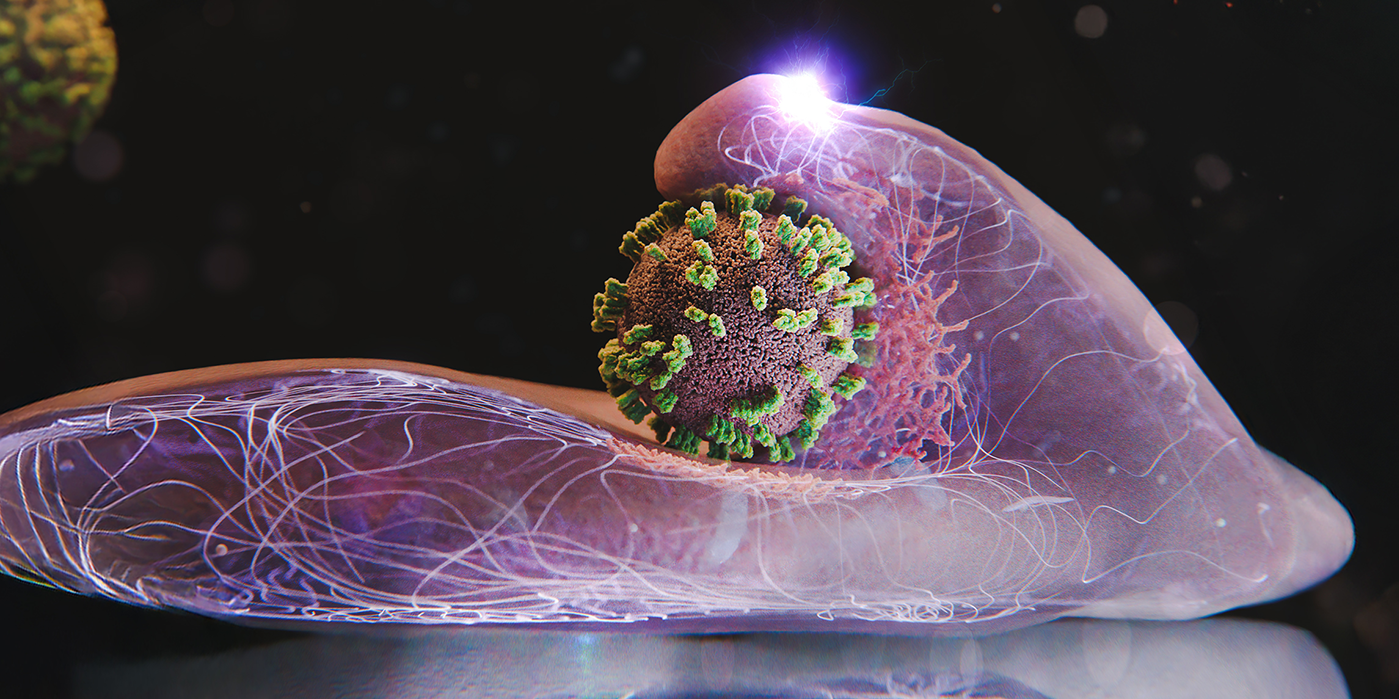
Zellen tragen aktiv zur Aufnahme und Inkorporation von Grippeviren bei. Hier eine Zelle und ein Virus im Zentrum des Bildes.
Illustration: Emma Hyde / ETH Zürich
Das molekulare Ballett der Infektion
Die Studie, die von Teams der ETH Zürich und der Hokkaido Universität mitverfasst wurde, nutzte eine innovative Kombination aus Rasterkraftmikroskopie und konfokaler Fluoreszenzmikroskopie. Diese Methode, genannt ViViD-AFM und beschrieben in den Proceedings der US-amerikanischen Nationalen Akademie der Wissenschaften (PNAS), ermöglicht es, gleichzeitig die Topographie der Zelle und die Position fluoreszenzmarkierter Viren zu verfolgen. Im Gegensatz zu zerstörenden Techniken wie der Elektronenmikroskopie bleibt die Zelle am Leben und erfasst so die volle Dynamik des Prozesses.
Die gewonnenen Bilder zeigen, dass das Virus nicht einfach gewaltsam eindringt. Es bewegt sich seitlich entlang der Zellmembran und erkundet ihre Oberfläche in einer Bewegung, die die Forscher mit Surfen vergleichen. Diese Navigation wird durch die Wechselwirkung zwischen den Hämagglutinin-Proteinen auf der Virusoberfläche und den auf der Zelle vorhandenen Sialinsäure-Rezeptoren geleitet. Das Virion sucht so nach einem Bereich, der reich an diesen Rezeptoren ist, einem optimalen Ankerpunkt, um den internen Prozess zu starten.
Was die Forscher am meisten überraschte, war die aktive Reaktion der Zelle während dieser Phase. Die Membran bleibt nicht inert. An der Stelle, an der sich das Virus anheftet, bildet sie dynamische Ausstülpungen und Wellen, als ob sie versuchte, den Eindringling zu ergreifen oder einzudämmen. Diese Aktivität, die vom Aktin-Zytoskelett der Zelle vermittelt wird, ist normalerweise wesentlichen Funktionen wie der Nährstoffaufnahme vorbehalten, ein Mechanismus, den das Virus zu seinem Vorteil umlenkt.
Eine offene Tür zu neuen Therapien
Die Präzision dieser neuen Bildgebungsmethode ermöglicht es nun, jeden Schritt des Viruseintritts mit beispielloser Genauigkeit zu sezieren. Die Wissenschaftler konnten die lokalisierte Rekrutierung von Clathrin beobachten, einem Protein, das eine Endozytose-Vesikel formt, um das Virus zu internalisieren. Sie stellten auch fest, dass die Intensität der Membranbewegungen zunahm, wenn das Virus drohte, sich zu lösen, was auf einen aktiven Zurückhaltungsversuch durch die Zelle hindeutet.
Diese Fähigkeit, die Infektion live zu beobachten, eröffnet vielversprechende Wege für das Screening therapeutischer Moleküle. Es wird möglich, die Wirksamkeit antiviraler Medikamentenkandidaten in Zellkultur zu testen und ihre Auswirkung auf den Eintrittsprozess in Echtzeit zu visualisieren. So kann überprüft werden, ob eine Verbindung die Anheftung des Virus, sein Membran-"Surfen" oder die Bildung des Internaliserungsvesikels wirksam blockiert.
Schließlich beschränkt sich die Reichweite dieser Technologie nicht auf das Influenza-Virus, das für die Grippe verantwortlich ist. Die Autoren betonen, dass die ViViD-AFM-Plattform angepasst werden kann, um die Interaktion anderer viraler Krankheitserreger mit Zellen zu untersuchen oder sogar das Verhalten von Impfstoff-Nanopartikeln zu beobachten. Sie bietet somit ein universelles Beobachtungsfenster auf die nanoskopischen Ereignisse, die die Wechselwirkungen an der Zellgrenzfläche steuern – ein mächtiges Werkzeug für die Grundlagenbiologie und die translationale medizinische Forschung.