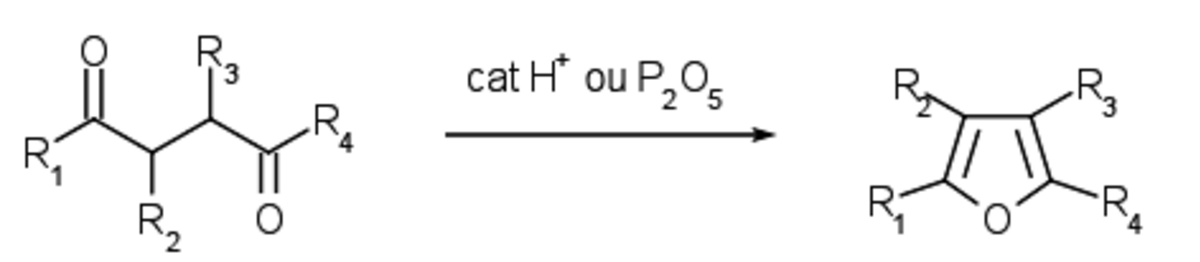Furane - Définition
La liste des auteurs de cet article est disponible ici.
Introduction
| Furane | |||
|---|---|---|---|
 | |||
| Général | |||
| Synonymes | Furfuranne | ||
| No CAS | |||
| No EINECS | |||
| PubChem | |||
| SMILES | |||
| InChI | |||
| Apparence | liquide incolore limpide tournant au brun avec le temps, d'odeur caractéristique. | ||
| Propriétés chimiques | |||
| Formule brute | C4H4O | ||
| Masse molaire | 68,074 ± 0,0038 g·mol-1 | ||
| Moment dipolaire | 0,66 ± 0,01 D | ||
| Diamètre moléculaire | 0,502 nm | ||
| Propriétés physiques | |||
| T° fusion | -85,6 °C | ||
| T° ébullition | 31,5 °C | ||
| Solubilité | 10 g·l-1 (eau, 20 °C) | ||
| Masse volumique | 0,9644 g·cm−3 (0°C) | ||
| T° d’auto-inflammation | 390 °C | ||
| Point d’éclair | -35 °C | ||
| Limites d’explosivité dans l’air | 2,3–14,3 %vol | ||
| Pression de vapeur saturante | 0,658 bar à 20 °C 1,0 bar à 30 °C 1,907 bar à 50 °C 3,105 bar à 65 °C | ||
| Point critique | 55,0 bar, 217,05 °C | ||
| Thermochimie | |||
| Cp | |||
| Propriétés électroniques | |||
| 1re énergie d'ionisation | 8,883 ± 0,003 eV (gaz) | ||
| Propriétés optiques | |||
| Indice de réfraction | |||
| Précautions | |||
| | |||
| |||
| Phrases R : 12, 19, 20/22, 38, 45, 48/22, 52/53, 68, | |||
| Phrases S : 45, 51, 53, | |||
| | |||
| |||
| | |||
|
4 2 1 | |||
| | |||
  | |||
| | |||
  Danger | |||
| | |||
| Groupe 2B : Peut-être cancérogène pour l'homme | |||
| Écotoxicologie | |||
| DL | 7 mg·kg-1 (Souris, i.p.) 5,2 mg·kg-1 (Rats, i.p.) | ||
| CL | Rat : 20 ppm pour 4 heures | ||
| LogP | 1,34 | ||
| | |||
Le furane, de formule brute C4H4O, est un composé hétérocyclique simple et fondamental, constitué d'un cycle aromatique de 5 atomes dont un atome d'oxygène. Il existe sous la forme d'un liquide incolore très volatile. Le furane est un composé aromatique qui possède une réactivité différente du benzène. Il est utilisé en tant que réactif ou précurseur en chimie organique.
Synthèse
Le furane a été synthétisé pour la première fois en 1870 par Heinrich Limpricht et fut alors appelé tétraphénol.
Synthèse industrielle
Une des sources principales du furane est le furfural obtenu par distillation de dérivés végétaux (notamment des céréales). Le furfural est ensuite décarboxylé par catalyse pour produire le furane. 2 voies de synthèse sont connues:
- 1) La méthode originelle transforme le furfural en furane, hydrogène, et dioxyde de carbone en présence de vapeur et d'un catalyseur de zinc-fer ou zinc-manganèse. Le mélange vapeur-furfural avec un ratio 1:5-1:10 est chauffée à 400 °C et le rendement en furane est supérieur à 90 %.
- 2) En 1959, DuPont met au point un voie de synthèse utilisant un catalyseur en platine, ce qui permet d'éviter l'utilisation de vapeur. Le furfural est directement décomposé en furane et monoxyde de carbone sous pression et à une température de 200 °C.
Une autre possibilité est l'oxydation partielle du 1,3-butadiène. Cette technique a été développée par DuPont en 1957. La réaction utilise un oxyde de molybdène (MoO3) comme catalyseur à une température de 500 °C. Divers catalyseurs permettent également cette réaction : oxyde de phosphore et de vanadium ou oxyde d'antimoine dopé à l'étain, au cuivre ou encore au tungstène. Toutefois les rendements sont inférieurs à 15%.
DuPont a continué le développement sur cette voie et, en 1987, un procédé à basse température (90 à 120 °C) a été mis au point. Le réactif 1,3-butadiène est vaporisé puis oxydé par du dichlorure de cuivre dans une solution aqueuse de mono- et dichlorure de cuivre avec présence de chlorure de sodium, de iodure de potassium et d'acide chlorhydrique. Une sélectivité de plus de 90 % est reportée pour une conversion du 1,3-butadiène de 20%.
Synthèse de laboratoire
Le furane et ses dérivés substitués peuvent être obtenus à partir de systèmes ouverts, ce qui permet l'accès direct à des dérivés fortement fonctionnalisés, notamment la déshydratation de pentan-2,4-diones substituées permet d'accéder aux furanes 3,4-substitués, assez complexes à obtenir par d'autres voies. La synthèse de Paal Knorr est une des synthèses les plus simples et permet à partir de 1,4 dicétone et de pentoxyde de phosphore d'obtenir du furane.
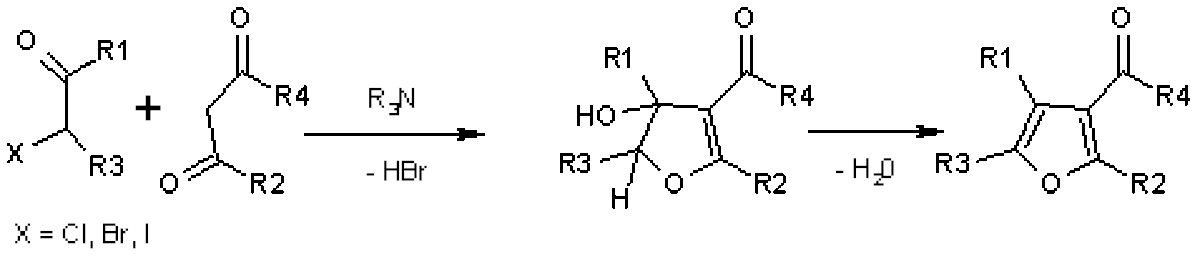
La synthèse de Feist-Benary fait réagir le carbanion d'un β-cétoester avec le carbonyle d'une cétone α-halogénée puis une substitution nucléophile intramoléculaire a lieu pour former un cycle qui donne par déshydratation un furane.
D'autres synthèses du furane sont possibles à partir de cycloadditions ou de réaction de Diels-Alder.