Restez toujours informé: suivez-nous sur Google Actualités (icone ☆)
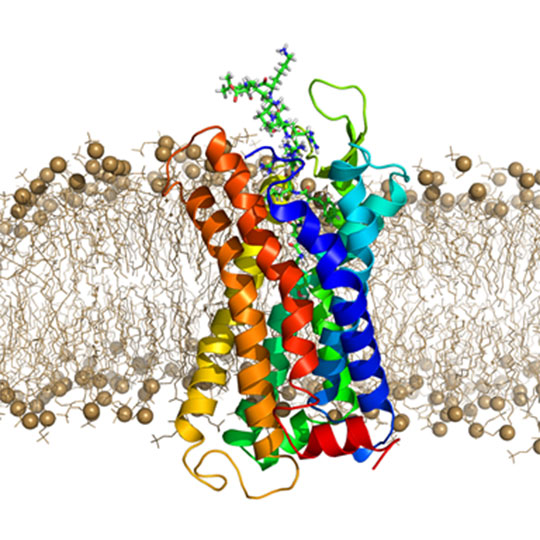
Figure: Structure tridimensionnelle du complexe dynorphine-récepteur kappa aux opiacés inséré dans une bicouche lipidique
© George Czaplicki
Le récepteur Kappa aux opiacés (KOR) est impliqué dans des processus physiologiques et pathologiques importants, tels que la perception de la douleur, la toxicomanie ou le sentiment de bien-être et la dépression. Ce récepteur membranaire fait partie de la grande famille des récepteurs couplés aux protéines G (RCPG) qui est la cible d'environ 30% des médicaments et dont le mécanisme d'action a été depuis 30 ans un défi majeur de la biologie cellulaire et structurale. Ainsi les avancées récentes dans la compréhension des structures et des mécanismes d'activation des RCPG ont-ils valu à B. Kobilka et R. Lefkowitz le prix Nobel de Chimie en 2012. Malgré la résolution depuis 2007 d'une centaine de structures tridimensionnelles de RCPG, leurs interactions avec les neuropeptides endogènes demeurent largement méconnues.
En utilisant la Résonance Magnétique Nucléaire, l'équipe d'Alain Milon, en collaboration avec les équipes de R.C. Stevens et K. Wüthrich (prix Nobel de chimie 2002) au Scripps Research Institute (USA) a résolu la structure de la dynorphine liée à son récepteur et levé le voile sur le mécanisme d'activation du récepteur KOR par la dynorphine, le ligand peptidique naturel du récepteur kappa. Des expériences de relaxation de l'azote 15 ont montré que le complexe peptide-récepteur demeure très dynamique, en accord avec les simulations par dynamique moléculaire qui montrent la coexistence de plusieurs complexes peptide-récepteur en équilibre rapide les uns avec les autres.
Ces résultats révèlent un mécanisme d'activation en plusieurs étapes, impliquant la formation d'un premier complexe peptide-récepteur suivi de réarrangements structuraux lors de l'interaction du récepteur avec les protéines G inhibitrices.
Cette étude apporte de nouveaux éléments à la connaissance fine des mécanismes moléculaires mis en jeu lors de l'activation du récepteur KOR, et permet d'entrevoir le développement de drogues antidouleur ou anti-dépression plus spécifiques, c'est-à-dire capables d'apporter le bénéfice thérapeutique désiré en évitant des effets secondaires causés par l'activation de voies de signalisation multiples.