Restez toujours informé: suivez-nous sur Google Actualités (icone ☆)
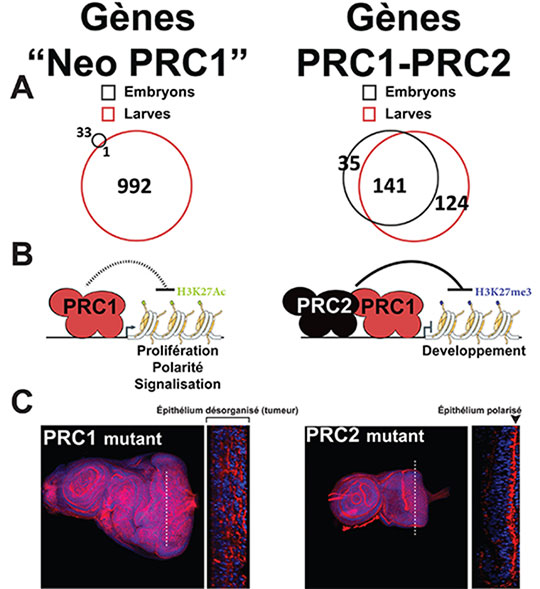
Figure: Le complexe PRC1 est recruté au cours du développement, sans le complexe PRC2, sur un ensemble de gènes ("Neo PRC1") dont la dérégulation transcriptionnelle participe à la formation de tumeurs. A- Diagrammes de Venn montrant le nombre de gènes ciblés par le PRC1 seul (à gauche) ou par le PRC1 accompagné du PRC2 (à droite) aux stades embryonnaire (noir) et larvaire (rouge). B- Schéma représentant les caractéristiques moléculaires inhérentes aux deux types de cibles ("Neo PRC1" ou PRC1-PRC2). Les fonctions des gènes cibles sont inscrites sous les schémas. C- Tissus épithéliaux de drosophile (disque imaginal oeil-antenne) marqués afin de visualiser les noyaux des cellules (bleu) ainsi que la polarité du tissu (rouge). Les pointillés blancs indiquent l'endroit où les coupes orthogonales (visibles sur la droite de chaque image) ont été réalisées.
© Vincent Loubière
Les protéines du Groupe Polycomb (PcG) sont des facteurs épigénétiques très conservés au cours de l'évolution et initialement découvertes chez la mouche Drosophila melanogaster comme répresseurs des gènes homéotiques. Au niveau de ces derniers, les protéines du PcG exercent leur fonction via l'action séquentielle de deux complexes protéiques appelés PRC1 et PRC2 qui maintiennent la répression des gènes homéotiques à travers toutes les phases du développement de l'organisme. Les complexes PRCs sont ainsi capables de maintenir la mémoire d'un état cellulaire à travers les divisions cellulaires depuis le stade embryonnaire jusqu'au stade adulte.
Néanmoins, les protéines du PcG sont également impliquées dans plusieurs fonctions biologiques telles que le renouvellement des cellules souches et les processus de cancérisation. L'équipe de Giacomo Cavalli avait montré que des mutations dans le gène polyhomeotic, un gène du groupe Polycomb, pouvaient induire des cancers néoplastiques chez la mouche et que la fonction de suppresseur de tumeurs de ce gène s'exerçait notamment par la répression de la voie de signalisation Notch.
L'établissement d'un lien entre Polycomb et Notch, un oncogène majeur, a ouvert la porte à une analyse systématique des mutations touchant les différents gènes du PcG. Cette nouvelle étude révèle que seules les mutations affectant les membres du PRC1 conduisent à la génération de tumeurs alors que les mutations affectant les membres du PRC2 ne présentent pas cette caractéristique. Ceci démontre que la fonction suppresseur de tumeurs est assurée par le PRC1 et non pas par le PRC2. Ce résultat rompt avec le paradigme établi antérieurement d'une action séquentielle et collaborative de ces 2 complexes PRCs majeurs.
L'équipe a étudié plus avant ce découplage fonctionnel entre PRC1 et PRC2, relativement à la fonction suppresseur de tumeurs, en réalisant une analyse comparative chez la drosophile des cibles du complexe PRC1 aux stades embryonnaire et larvaire, en particulier dans les disques imaginaux. En effet, ces structures larvaires qui préfigurent le futur adulte, possèdent, contrairement à l'embryon, un cycle cellulaire similaire à celui des cellules humaines. Ces travaux, dirigés par Anne-Marie Martinez et Giacomo Cavalli, ont permis de visualiser, entre le stade embryonnaire et larvaire, une vague massive de recrutement du PRC1, indépendante de l'action du PRC2, au niveau des centaines de gènes cibles qui partagent la caractéristique d'être impliqués dans le contrôle de la prolifération, la polarité et la signalisation cellulaires. Ces gènes, qui ne sont pas reconnus par le PRC1 dans l'embryon, sont surexprimés dans les larves mutantes pour le PRC1 et pas dans les mutants PRC2. En parallèle, et comme attendu, les gènes ciblés conjointement par le PRC1 et le PRC2 au stade embryonnaire (une centaine), sont maintenus dans un état réprimé au stade larvaire.
Cette étude prouve que l'action physiologique majeure du PRC1 est en réalité de réguler finement, tant du point temporel que spatial, l'action de gènes dont la dérégulation conduit à la formation de tumeurs. Par ailleurs, ce redéploiement dynamique du PRC1 au cours du développement semble conservé au plan évolutif. Alors que dans les cellules souches humaines, le complexe PRC1 co-localise au niveau de ses cibles avec la marque épigénétique déposée par le PRC2, cela n'est pas le cas dans les cellules différenciées où le PRC1 est recruté sur une grand groupe de gènes associés à des fonctions contrôlant la prolifération et la signalisation cellulaires, à l'instar de ce qui se produit chez la larve de drosophile. Des études ultérieures chez la drosophile et l'homme, visant à élucider les mécanismes moléculaires de ce processus, pourraient avoir des applications diagnostiques et thérapeutiques en cancérogenèse.