Restez toujours informé: suivez-nous sur Google Actualités (icone ☆)
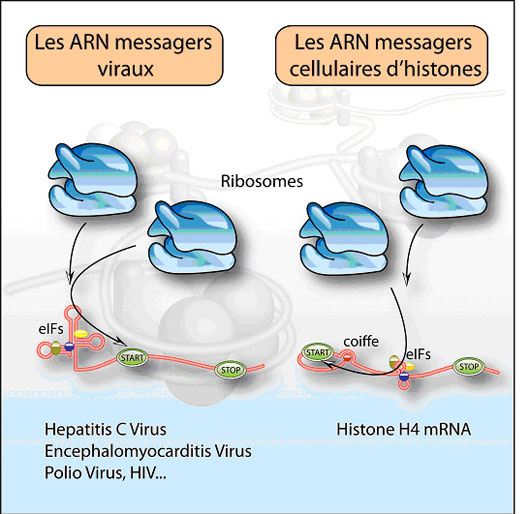
Figure: Les ARN messagers viraux contiennent des éléments structuraux, les IRES, qui fixent les facteurs d'initiation de la traduction (eIFs). Ceci permet le recrutement des ribosomes pour la traduction des ARNm viraux, sans nécessiter la présence d'une coiffe. L'ARN messager de l'histone H4 contient bien une coiffe, mais elle est inaccessible aux eIFs car elle est enfouie dans une poche formée par l'ARNm. Les eIFs doivent alors se fixer sur des structures à l'intérieur de l'ARNm, permettant ainsi le dépôt des ribosomes sur le codon START. Cet ARN messager permet la synthèse de l'histone H4, protéine qui entre dans la composition de la chromatine (représentée en arrière plan).
© ARN, F. Martin
La biosynthèse des protéines dans la cellule est appelée traduction. Elle a lieu au niveau du ribosome, qui assemble les acides aminés transportés par les ARN de transfert (ARNt), en fonction de l'information portée par la séquence nucléotidique de l'ARN messager (ARNm). La traduction protéique se décompose en fait en trois étapes: l'initiation, qui correspond à la formation d'un complexe d'initiation, l'élongation, qui permet d'accrocher un nouvel acide aminé à la chaîne peptidique en cours de synthèse, et la terminaison, qui conduit à la libération de la protéine.
Chez les eucaryotes, l'initiation est l'étape la plus complexe et la plus régulée. Elle fait intervenir une pléiade de facteurs destinés à recruter la petite sous-unité du ribosome et l'ARNt(Met) initiateur à proximité de l'extrémité 5' de l'ARNm qui porte la coiffe. Une fois cet assemblage réalisé, un processus de "scanning" de l'ARNm permet au complexe d'initiation de parcourir l'ARNm jusqu'au premier codon AUG initiateur. La longueur de la région non codante précédant l'AUG initiateur est très variable, pouvant atteindre plusieurs centaines de bases, la moyenne se situant autour de 60 nucléotides. Le processus de scanning de l'ARNm ajoute de la complexité au mécanisme d'initiation, faisant de cette étape d'initiation l'étape limitante de la traduction.
Afin de gagner en efficacité, les virus ont développé un système simplifié leur permettant de pirater la machinerie traductionnelle de la cellule eucaryote infectée. Des séquences particulières localisées sur l'ARNm viral, les IRES ou "Internal ribosome entry site", permettent le démarrage de la traduction de manière interne, avec un recrutement direct du ribosome au niveau du codon AUG de démarrage. Grâce à ces IRES, les virus s'affranchissent ainsi des étapes de fixation de la coiffe et de scanning.
L'équipe de Gilbert Eriani au sein de l'unité Architecture et Réactivité de l'ARN (ARN), est parvenue à montrer que la traduction de l'histone H4 est initiée par un mécanisme original, reprenant à la fois certaines caractéristiques cellulaires (présence d'une coiffe) et virales (absence de scanning et entrée interne des ribosomes). Contrairement aux ARN messagers classiques, la coiffe de l'ARNm de l'histone H4 n'est pas accessible car elle est enfouie dans une poche formée par la phase codante. De ce fait, le facteur qui normalement reconnaît la coiffe est recruté à l'intérieur de l'ARNm. Ceci permet l'assemblage des ribosomes qui sont ainsi directement positionnés sur l'AUG initiateur. Ce mécanisme simplifié de "tethering" assure donc un démarrage immédiat de la traduction, sans étape de scanning, coûteuse en temps et en énergie. C'est la première fois qu'un tel processus est démontré pour les ribosomes. Il pourrait notamment expliquer la production massive en histone, destinée à compacter l'ADN synthétisé juste avant la division cellulaire.
La découverte de ce mécanisme d'initiation pour la traduction de l'ARNm de l'histone H4, ouvre la voie au développement de nouveaux composés chimiques, destinés à bloquer la division cellulaire et agissant sur l'empaquetage de l'ADN précédant la division. Les chercheurs orientent maintenant leurs travaux vers la résolution de la structure tridimensionnelle de ce type de complexe d'initiation, l'examen du démarrage de la traduction des autres histones (H2A, H2B, H3) et la détermination de l'importance du phénomène d'initiation par "tethering" dans la cellule.