Restez toujours informé: suivez-nous sur Google Actualités (icone ☆)
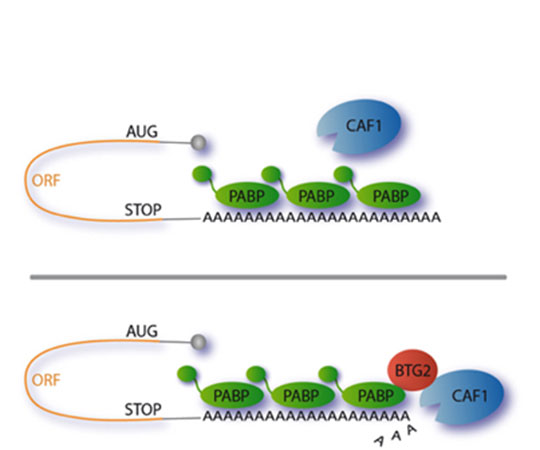
Figure: Mécanisme de stimulation du raccourcissement de la queue poly(A) des ARN messagers par BTG2. En l'absence de BTG2, la désadénylase CAF1 a une activité limitée (illustration du haut). BTG2, qui a la capacité de lier aussi bien la désadénylase CAF1 que la protéine Poly(A)-Binding (PABP), permet de recruter et de positionner efficacement CAF1 sur son substrat: la queue poly(A) des ARN messagers. Ainsi, BTG2 stimule la dégradation de la queue poly(A) par CAF1 (partie du bas).
© Fabienne Mauxion
L'expression du patrimoine génétique aboutit à la production de protéines à partir d'ARN messagers (ARNm). La nature et la quantité des ARNm présents dans une cellule sont essentielles pour le bon fonctionnement de celle-ci. Plusieurs voies impliquées dans la dégradation des ARNm eucaryotes ont été identifiées. Chez l'homme, comme chez les autres eucaryotes, la première étape de ces voies de dégradation est généralement le raccourcissement de leur queue poly(A). Cette étape, appelée désadénylation, est dans la plupart des cas catalysée par la désadénylase CAF1. La protéine BTG2 fait partie de la famille de protéines BTG/Tob qui se caractérisent par un mode commun d'interaction avec la désadénylase CAF1. BTG2 avait été impliquée dans de nombreux processus biologiques au cours du développement embryonnaire et de la différentiation cellulaire. De plus, la quantité de BTG2 est moindre dans les cellules cancéreuses par comparaison avec les cellules normales et son niveau d'expression est corrélé avec le grade des tumeurs et la survie des patients. Cependant, sa fonction moléculaire précise restait non élucidée.
L'équipe de Bertrand Séraphin dont l'objectif est de comprendre comment le processus de dégradation de l'ARN contribue à la régulation de l'expression génique et à l'élimination des transcrits défectueux, avait précédemment observé que l'expression de BTG2 dans des cellules stimulait la dégradation des ARNm par un mécanisme inconnu. Cette nouvelle étude révèle une interaction inattendue de la protéine BTG2 avec les domaines de liaison au poly(A) de la protéine PABP. Cette dernière recouvre les queues poly(A) des ARNm dans les cellules. Ces observations ont permis de reconstituer pour la première fois la stimulation de l'activité désadénylase de CAF1 in vitro. Ce processus implique les protéines BTG2 et PABP seulement.
Les chercheurs démontrent qu'au travers de son interaction avec PABP et de sa capacité à stimuler la désadénylation, BTG2 limite la prolifération cellulaire. De nouvelles études permettront de tester si un niveau réduit de BTG2 favorise la croissance rapide et incontrôlée des cellules cancéreuses. Des traitements contrôlant le niveau de BTG2 pourraient alors être envisagés.