Ein Team des Labors Materie und komplexe Systeme und der Flinders-Universität (Australien) hat gerade gezeigt, dass die Mechanismen zur Erkennung von Kräften erheblich von denen abweichen, die üblicherweise bei der Übertragung elektrischer neuronaler Signale zum Einsatz kommen. Diese Arbeiten, die im Journal of Experimental Physiology veröffentlicht wurden, heben somit eine neue Besonderheit des enterischen Nervensystems hervor.
Abbildung zur Illustration von Pixabay
Der einzige innervierte Organ unseres Körpers ist der Darm, der über ein eigenes Nervensystem verfügt. Er beherbergt hundert Millionen Neuronen, die nur durch zweitausend Axone mit dem zentralen Nervensystem verbunden sind. Dieses enterische Nervensystem erkennt unter anderem den mechanischen Druck, der durch den Nahrungsbolus ausgeübt wird, um die nächsten Verdauungsaktionen der Darmmuskulatur zu steuern: Transport, Mischen oder Ausscheidung.
Ein besseres Verständnis dafür, wie der Darm auf diese mechanischen Reize reagiert, würde Aufschluss über die Regulierung der Darmmotilität geben und somit über damit verbundene Krankheiten wie das Reizdarmsyndrom, das 10 % der Bevölkerung betrifft. Die elektrische Aktivität der Neuronen hängt von Natriumkanälen ab, die die Ausbreitung von Aktionspotentialen ermöglichen und somit den Nervenimpuls übertragen.
Forscher des Labors Materie und komplexe Systeme (MSC, CNRS/Université Paris Cité) und der Flinders-Universität (Australien) haben entdeckt, dass die Darmneuronen bereits ab ihrer Differenzierung mechanosensitive Eigenschaften aufweisen, die mechanischen Druck jedoch nicht durch Aktionspotenziale erkennen.
Die Wissenschaftler untersuchten dazu die Darmtrakte von genetisch modifizierten Mäusen, deren Zellen in Abhängigkeit von ihrer elektrischen Aktivierung fluoreszieren. Die Proben wurden während einer kritischen Phase der embryonalen Entwicklung entnommen, als die Darmbewegungen von rein muskulärer Aktivität zu einer durch das enterische Nervensystem modifizierten Aktivität übergingen. Die Neuronen fluoreszierten bei den mechanischen Reizen und waren daher bereits mechanosensitiv.
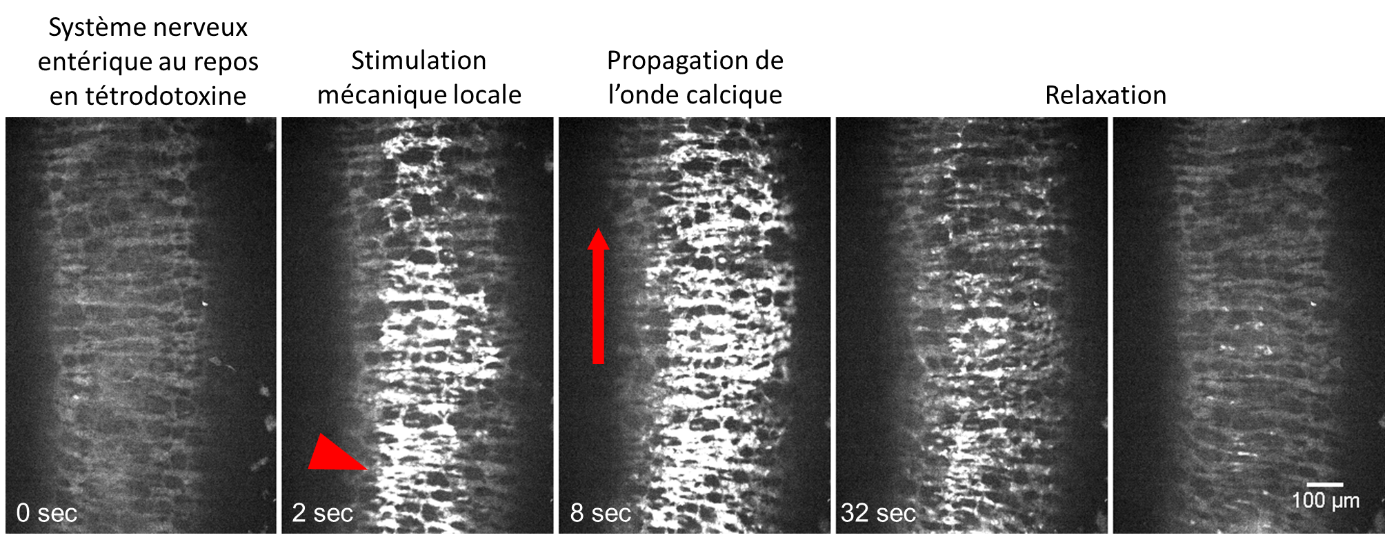
Standbilder bei mechanischer Stimulation des Nervensystems des Mausdarms, der in Tetrodotoxin gehalten wird. Die Fluoreszenz entspricht dem Kalziumspiegel in den Neuronen, was auf die Ausbreitung eines elektrischen Signals hinweist.
© Amedzrovi Agbesi et al.
Das Team injizierte danach Tetrodotoxin, das vom in Japan als Fugu geschätzten Kugelfisch stammt und die Natriumkanäle blockiert. Diese Moleküle, die in der Zellmembran vorkommen, steuern den Austausch von Natriumionen zwischen dem Inneren der Zellen und der äußeren Umgebung. Während Tetrodotoxin seit langem bekannt dafür ist, die Aktionspotentiale und somit das Funktionieren der Neuronen vollständig zu stoppen, wurde die mechanosensitive Antwort überhaupt nicht beeinträchtigt.
Die bemerkenswerte Widerstandsfähigkeit dieser Antwort gegen eine ganze Serie von Inhibitoren von Ionenkanälen, über die Natriumkanäle hinaus, lässt vermuten, dass es sich größtenteils um ein intrazelluläres Phänomen handelt, das auf der Auflösung von Kalziumspeichern innerhalb der Zelle bei mechanischer Belastung beruht.
Die Autoren sind sich jedoch noch nicht sicher, ob dies das gesamte Phänomen erklärt und planen, ihre Untersuchungen fortzusetzen. Sie haben auch herausgefunden, dass Kalziumkanäle eine sehr wichtige Rolle bei der Generierung spontaner elektrischer Signale der Darmneuronen spielen.
Forscher, die das enterische Nervensystem untersuchen, verwenden oft Inhibitoren von Kalziumkanälen, die die natürlichen Darmkontraktionen blockieren und somit die Bildaufnahme erleichtern. Diese Forschungsergebnisse deuten darauf hin, dass diese übliche Praxis die Beobachtungen tatsächlich verfälschen könnte, indem sie mehr Funktionen als erwartet inhibiert.
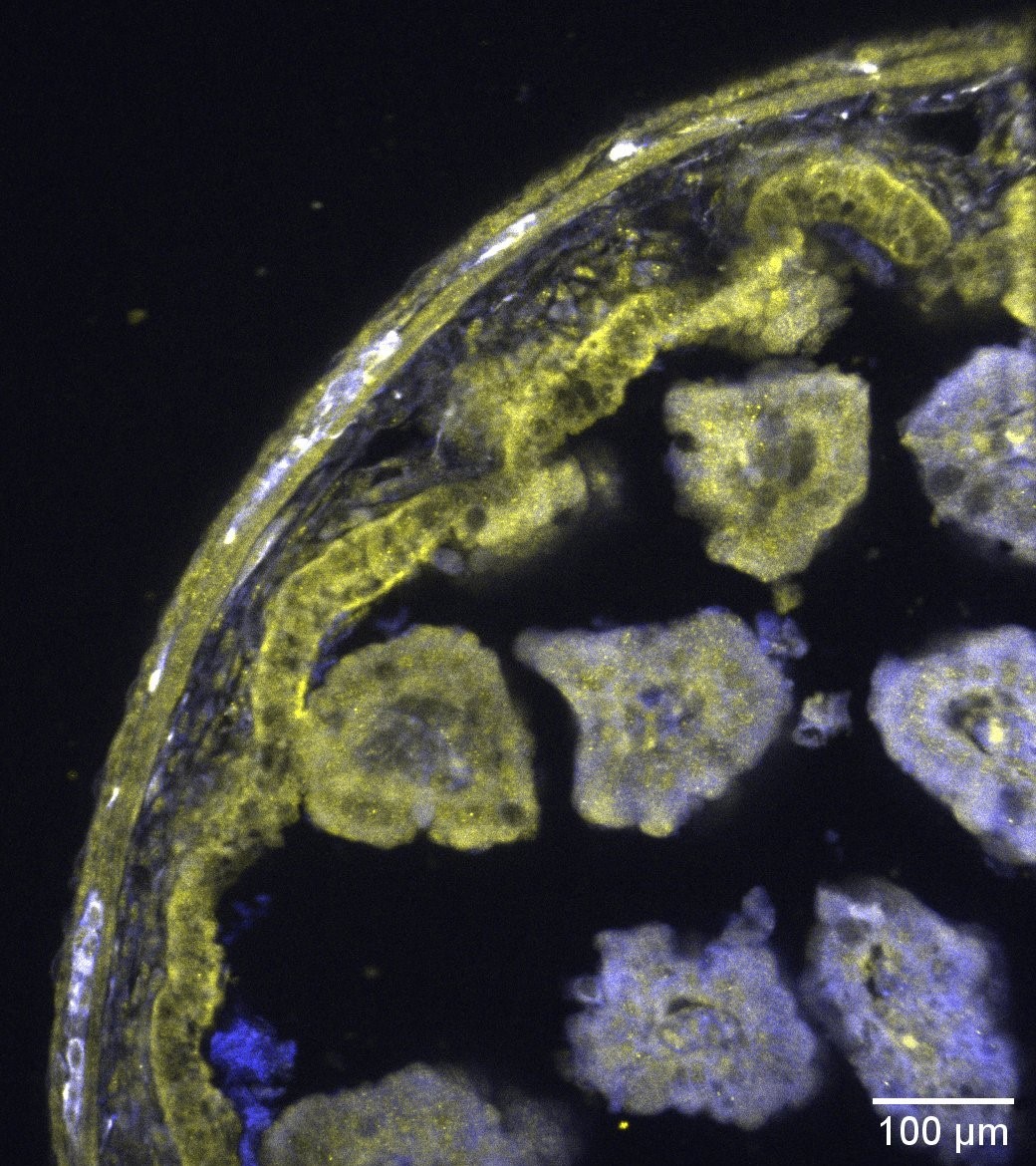
Die weißen Bereiche zeigen die Kolokalisation der Neuronen (blau) mit den L-Typ-Kalziumkanälen (gelb) auf diesem Querschnitt eines Mausdarms.
© Amedzrovi Agbesi et al.
Referenzen:
Tetrodotoxin-resistant mechano-sensitivity and L-type calcium channel-mediated spontaneous calcium activity in enteric neurons.
Richard J. Amedzrovi Agbesi, Amira El Merhie, Nick J. Spencer, Tim Hibberd und Nicolas R. Chevalier.
Journal of Experimental Physiology, 2024.
https://doi.org/10.1113/EP091977.