In einer in Nature veröffentlichten Studie zeigen französische und englische Chemiker, wie sehr einfache künstliche molekulare Motoren in der Lage sind, solche Arbeit zu verrichten, indem sie die Umwandlung eines chiralen chemischen Brennstoffs katalysieren. Dies könnte die Soft-Robotik und aktive Materie vorantreiben.

Illustrationsbild Pixabay
Wie können bestimmte Moleküle in einer chaotischen Umgebung organisierte und geordnete Arbeit verrichten? Die Welt der Moleküle, die in einer Flüssigkeit eingetaucht sind, wird tatsächlich durch einen stochastischen Prozess, die sogenannte Brownsche Bewegung, geregelt, die die zufälligen Bahnen der Teilchen beschreibt.
Eine bestimmte Bahn zu erzwingen, ist nicht einfacher, als sich in einem Wirbelsturm zu bewegen. Dennoch produzieren biologische Motoren, Proteine mit komplexen Strukturen, in dieser ungeordneten Umgebung eine perfekt definierte mechanische Arbeit.
Zum Beispiel ist Myosin-II für die Muskelkontraktion bei den meisten Tieren verantwortlich. Dazu wandelt dieses enzymatisch aktive Protein eine Quelle chemischer Energie (Adenosintriphosphat (ATP)) in ein Reaktionsprodukt (Adenosindiphosphat (ADP)) um.
Diese Umwandlung geht mit einer Kaskade perfekt geordneter Bewegungen einher, die sich in der makroskopischen Kontraktion des Muskelgewebes äußern. Der Mechanismus, der dieser Umwandlung von chemischer Energie in Arbeit zugrunde liegt, ist jedoch in der wissenschaftlichen Gemeinschaft noch immer umstritten.
Künstlicher Muskel, der rotierende molekulare Motoren verwendet und durch einen chiralen chemischen Brennstoff aktiviert wird. Die Rotationsrichtung der Motoren wird durch den enantiomeren Überschuss des Brennstoffs bestimmt, was die Kontrolle über die Kontraktion oder Dehnung des künstlichen Muskels ermöglicht.
© Nicolas Giuseppone
Im Rahmen des europäischen Kooperationsprojekts ITN-ArtMoMa ist es Chemikern des Institut Charles Sadron (CNRS/Universität Straßburg/Institut Universitaire de France) und der Universität Manchester gelungen, diese Frage mit einem minimalen chemischen System zu beantworten. Dazu kombinierten sie kleine rotierende Motoren (1000-mal kleiner als Myosin-II) mit einem Polymernetzwerk, um ein aktives Hydrogel zu bilden.
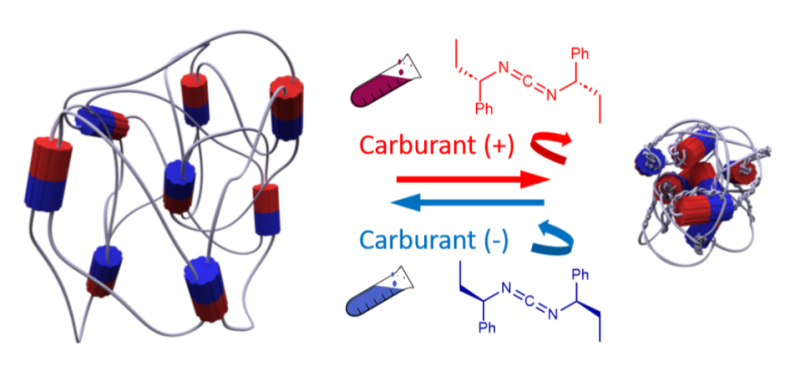
Die verwendeten molekularen Motoren bestehen aus einem statischen Teil (Stator) und einem beweglichen Teil (Rotor). Bei Zugabe eines chemischen Brennstoffs katalysiert der Motor die Umwandlung des Brennstoffs in ein Reaktionsprodukt, was die Rotation des Rotors durch eine geordnete Folge von Konformationsänderungen bewirkt.
Der chemisch an die Polymerketten gebundene Rotor bewirkt wiederum die Kontraktion oder Expansion des Materials, je nachdem, in welche Richtung er sich dreht. Diese bevorzugte Rotationsrichtung, die auf das Polymernetzwerk übertragen wird, wird durch die Chiralität des Brennstoffs bestimmt. Abhängig vom enantiomeren Überschuss des Brennstoffs wird eine makroskopische Kontraktion oder Dehnung des Hydrogels beobachtet.
Durch die Messung der Änderungen der Materialeigenschaften des Hydrogels konnten die Forscher auch die vom Motor erzeugte Kraft und seinen Energieeffizienz bestimmen.
Dieses sehr einfache System zeigt, wie ein Katalysator in der Lage ist, eine Quelle chemischer Energie in kontrollierte Bewegungen bis hin zur makroskopischen Ebene umzuwandeln, indem er die Asymmetrie der Geschwindigkeitskonstanten der am katalytischen Zyklus beteiligten Reaktionen ausnutzt.
Diese in der Zeitschrift Nature veröffentlichte Studie unterstreicht das Potenzial künstlicher molekularer Motoren, eines der großen Funktionsprinzipien des Lebens zu erklären. Sie könnte auch die Konzeption neuer aktiver Elemente im Bereich der Materialwissenschaften und Nanotechnologien inspirieren.
Referenz:
Transducing chemical energy through catalysis by an artificial molecular motor
Peng-Lai Wang, Stefan Borsley, Martin J. Power, Alessandro Cavasso, Nicolas Giuseppone & David Leigh.
Nature 2024
https://doi.org/10.1038/s41586-024-08288-x