Illustrationsbild Pixabay
Ihre Arbeit, die am 24. Juli 2025 in Science veröffentlicht wurde, enthüllt ein Prinzip der biologischen Konservierung, das neue Wege in der Immuntherapie eröffnet, indem es neuartige therapeutische Ziele vorschlägt, die aus der bakteriellen Evolution selbst stammen.
Lange Zeit waren Wissenschaftler der Ansicht, beim Menschen die wesentlichen Wege der angeborenen Immunität identifiziert zu haben, die die erste Verteidigungslinie des Organismus darstellt. Tatsächlich ermöglicht die angeborene Immunität die Erkennung bestimmter Krankheitserreger und die Auslösung einer schnellen Reaktion. Doch heute stellt die ursprüngliche Immunität, ein sich rasch entwickelndes Forschungsgebiet, dieses Dogma in Frage.
Durch die Erforschung der evolutionären Verbindungen zwischen bakteriellen und menschlichen Proteinen verstehen Forscherinnen und Forscher, dass eine beträchtliche Anzahl von Proteinen, die an der angeborenen Immunität beim Menschen beteiligt sind, von denen abstammt, die in Bakterien vorkommen. Diese Proteine sind nicht nur strukturell konserviert: Ihre Immunfunktion ist ebenfalls erhalten, manchmal über Milliarden von Jahren hinweg.
Bei Bakterien spielt die Proteindomäne SIR2 (silent information regulator 2) eine Schlüsselrolle in den Abwehrsystemen gegen Phagen, Viren, die spezifisch Bakterien infizieren. Wenn ein Phage in ein Bakterium eindringt, löst SIR2 den Abbau eines für den Zellstoffwechsel essenziellen Moleküls aus und verursacht den Tod der infizierten Zelle, wodurch der Rest der Kolonie geschützt wird.
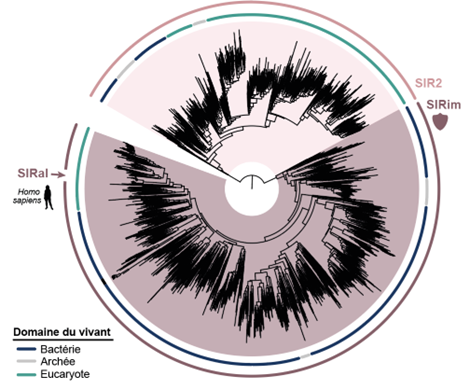
Phylogenetischer Baum, der auf bakteriellen (blau) und eukaryotischen (grün) Proteinen mit SIR2-Domäne basiert. Die Proteine verteilen sich auf zwei Unterfamilien, von denen eine, die Sirims, die immunologischen SIR2-Proteine enthält, darunter SIRal.
Durch die Rekonstruktion der Evolutionsgeschichte der Gene mittels Phylogenie[1] hat ein Team unter der Leitung von Dr. Enzo Poirier, Forscher am Inserm, Teamleiter am Institut Curie in der Abteilung Immunität und Krebs (Institut Curie, Inserm), und Dr. Aude Bernheim, Leiterin der Abteilung Molekulare Diversität der Mikroben am Institut Pasteur, beim Menschen ein Homolog der SIR2-Domäne namens SIRal identifiziert und seine Rolle in der angeborenen Immunität sowie seine Fähigkeit, NAD abzubauen, ein für den Zellstoffwechsel und die Energieproduktion essenzielles Molekül, nachgewiesen.
Die Entdeckung der biologischen Rolle von SIRal ist umso interessanter, als sie nicht nur ein einzelnes isoliertes Protein betrifft, sondern eine diversifizierte Familie von Proteinen, die in 19 % der analysierten eukaryotischen Genome, verteilt auf fünf große Linien, vorkommen. Diese Ergebnisse bestätigen, dass immunologische Mechanismen bakteriellen Ursprungs nicht nur vorhanden, sondern im gesamten Leben weitgehend konserviert sind, mit potenziellen Implikationen für alle Eukaryoten, einschließlich des Menschen.
Zusätzlich zum phylogenetischen Ansatz haben Dr. Delphine Bonhomme (Team Poirier), Hugo Vaysset (Team Bernheim) und ihre Kollegen demonstriert, dass SIRal als zentraler Regulator des TLR-Rezeptorwegs (Toll-like receptors) wirkt, einer Familie von Rezeptoren, die typische Signale von Krankheitserregern erkennen können.
Somit erleichtert dieser durch SIRal regulierte TLR-Weg die Expression proinflammatorischer Gene und löst die Immunreaktion aus. Sie zeigten, dass ohne SIRal die Entzündungsreaktion stark beeinträchtigt ist, sei es bei einer bakteriellen oder viralen Infektion.
"Mit SIRal zeigen wir, dass von Bakterien geerbte Elemente eine zentrale Rolle in eukaryotischen, insbesondere menschlichen Immunmechanismen spielen können. Aber weiter gefasst gibt uns die ursprüngliche Immunität Zugang zu einem unerwarteten Reservoir von Immunmechanismen", betont Enzo Poirier, Forscher am Inserm und Teamleiter am Institut Curie.
"Diese Entdeckung veranschaulicht, wie sehr die Evolution alte Bausteine wiederverwendet, um neue Funktionen zu schaffen: Mechanismen, die vor Milliarden von Jahren in Bakterien entstanden sind, prägen noch heute unsere Immunität", präzisiert Aude Bernheim, Leiterin der Abteilung Molekulare Diversität der Mikroben am Institut Pasteur.
Jenseits der Evolutionsbiologie sind die Implikationen der Entdeckung von SIRal klinisch. Tatsächlich hängen viele Autoimmunpathologien teilweise von der Aktivierung der TLR-Rezeptoren ab. SIRal stellt somit ein neuartiges therapeutisches Ziel dar und ebnet den Weg für Immuntherapien einer neuen Art.
Anmerkung:
[1] Die Phylogenie bezeichnet die Untersuchung der evolutionären Beziehungen zwischen Arten, mit dem Ziel, ihre Verwandtschaftsverhältnisse von einem gemeinsamen Vorfahren ausgehend zu rekonstruieren.