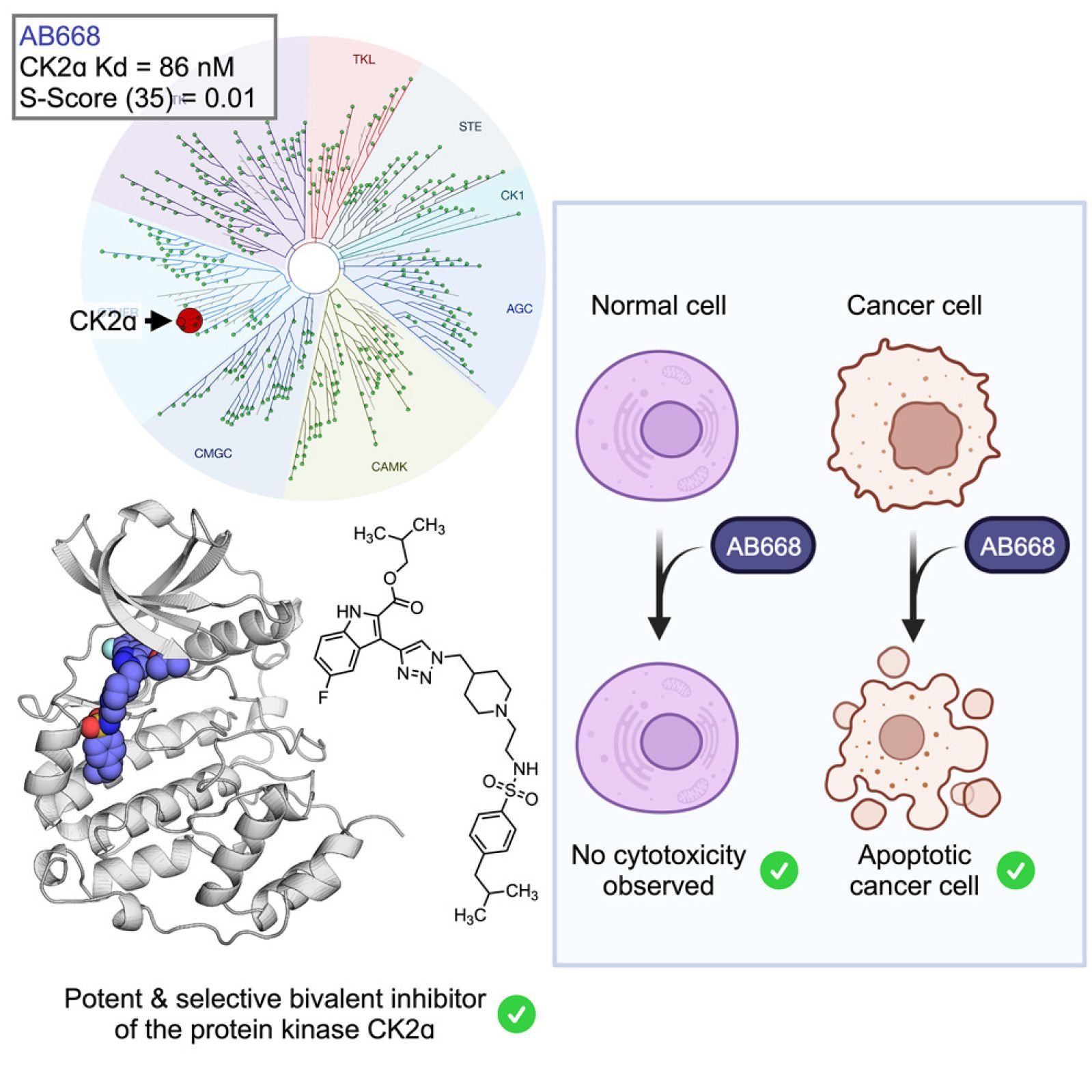
Para desenvolver novos tratamentos anticancerígenos, os pesquisadores do Irig focam na inibição seletiva da proteína-quinase CK2.
Os pesquisadores do Irig e da Faculdade de Farmácia de Lyon conseguiram sintetizar e caracterizar a molécula AB668 que inibe a atividade de CK2 com grande especificidade. Com efeito, essa molécula bivalente se liga simultaneamente ao sítio catalítico da CK2 e a uma bolsa hidrofóbica adjacente, conferindo-lhe um mecanismo de inibição único.
Além disso, a molécula AB668 não apresenta efeitos colaterais desfavoráveis, pois induz a morte por apoptose de diversas linhagens celulares derivadas de cânceres agressivos (rim, mama, melanoma, pâncreas, colón), ao mesmo tempo que poupa as células saudáveis.
Portanto, a molécula AB668 poderia representar um novo agente anticancerígeno promissor. O próximo passo será testar a molécula após sua otimização por química medicinal, em modelos pré-clínicos de diferentes cânceres.
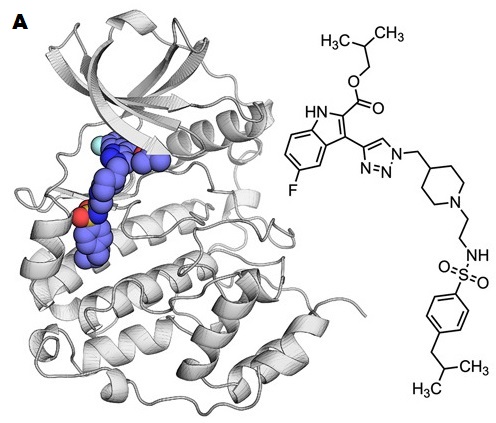
A molécula AB668 (azul) inibe exclusivamente a proteína CK2 ao se ligar simultaneamente ao seu sítio catalítico e a uma bolsa hidrofóbica adjacente.
AB668 induz a morte por apoptose das células tumorais, preservando as células saudáveis.
Referências
Bancet A, Frem R, Jeanneret F, Mularoni A, Bazelle P, Roelants R, Delcros JG, Guichou JF, Pillet C, Coste I, Renno T, Battail C, Cochet C, Lomberget T, Filhol O and Krimm I.
Cancer selective cell death induction by a bivalent CK2 inhibitor targeting the ATP site and the allosteric
αD pocket.
iScience 2024.