
Uma equipa da colaboração SAMURAI21-NeuLAND demonstrou, através do estudo de um núcleo muito próximo, o flúor-30, que este núcleo não é, afinal, mágico e que os seus nucleões não estão mais fortemente mantidos. Em vez disso, estabelece-se um regime de superfluidez, onde os neutrões saltam sem esforço entre orbitais emaranhadas.
Desde que assumiram o desafio de estudar o oxigénio-28, os cientistas da colaboração SAMURAI no Japão, com a participação de físicos e físicas do IN2P3, vêm sendo surpreendidos constantemente. A mais recente surpresa não é das menores.
Este núcleo, composto por 8 protões e 20 neutrões, é particularmente interessante porque, apesar das suas características intrínsecas, que deveriam fazer dele um núcleo "mágico", ou seja, mais estável do que os seus vizinhos, ele revela-se altamente instável: a sua vida útil não excede 10-20 segundos.
Os físicos procuraram, então, entender melhor o seu funcionamento intrínseco para avaliar se devia ou não ser considerado mágico. E o que descobriram é muito interessante. A prevalência da instabilidade deve-se à aproximação das orbitais nas quais os nucleões estão dispostos, o que permite a instalação de um regime de superfluidez.
Superfluidez? Para compreender bem esse fenómeno, vamos mergulhar nas bases da física nuclear.
Nos núcleos atómicos, a regra dita que, quando um núcleo tem exatamente o número necessário de nucleões para completar as suas orbitais, ele é mais estável e diz-se que é mágico. Este efeito será, aliás, duplicado se esse preenchimento ideal envolver tanto os protões quanto os neutrões. Nesse caso, fala-se de um núcleo duplamente mágico.
O oxigénio-28, com os seus 8 protões e 20 neutrões, faz parte dessa supercategoria e, por essa razão, teoricamente, devia ter uma estabilidade reforçada. Mas outra regra igualmente implacável da física nuclear atua em sentido oposto. Desta vez, é a diferença entre o número de protões e o número de neutrões que conta.
Os núcleos mais estáveis possuem uma quantidade sensivelmente igual de ambos. Porém, à medida que essa diferença aumenta, os núcleos tornam-se cada vez menos estáveis. Com 20 neutrões e 8 protões, o oxigénio-28 tem uma forte tendência para a instabilidade. E no final, não há dúvida: com sua vida útil ínfima, fica evidente que as regras da instabilidade reinam supremas. Restava saber porquê.
Para explorar a magicidade do oxigénio-28, os cientistas procuraram comparar a energia necessária para arrancar um neutrão ao oxigénio-28 com a energia necessária para fazer o mesmo ao oxigénio-29, que tem um neutrão a mais. A ideia é que, sendo o oxigénio-28 mágico, ele devia reter os seus neutrões com mais firmeza que o oxigénio-29. No entanto, a curta duração de vida desses dois isótopos e, sobretudo, o modo de decaimento do oxigénio-29 tornam esse teste extremamente difícil.
Os cientistas da colaboração SAMURAI21-NeuLAND propuseram, então, contornar o problema estudando núcleos muito próximos em número de nucleões, como o flúor-30 (9 protões, 21 neutrões) e o flúor-29 (9 protões, 20 neutrões). A proximidade entre os dois elementos permite, de facto, extrapolar o resultado dos isótopos de flúor para os de oxigénio.
As medições obtidas são inequívocas: a energia necessária para ejetar um neutrão de cada um dos dois isótopos de flúor é comparável, o que prova que a configuração "mágica" e estabilizadora de 20 neutrões já não existe.
"Estimamos que, nesta configuração, envolvendo núcleos muito pouco ligados e extremamente instáveis, as orbitais bem definidas que habitualmente encontramos dão lugar a um emaranhado de orbitais entre as quais os neutrões podem circular livremente, explica Olivier Sorlin, investigador do GANIL e participante no estudo da SAMURAI21-NeuLAND. Este novo regime que se estabelece é provavelmente o da superfluidez, onde os neutrões emparelham-se entre si e saltam de uma órbita para outra de maneira indiscriminada. Nesse contexto, as regras da magicidade, determinadas pelo preenchimento ou não de certas orbitais, já não se aplicam. É por isso que o oxigénio-28 não é mágico."
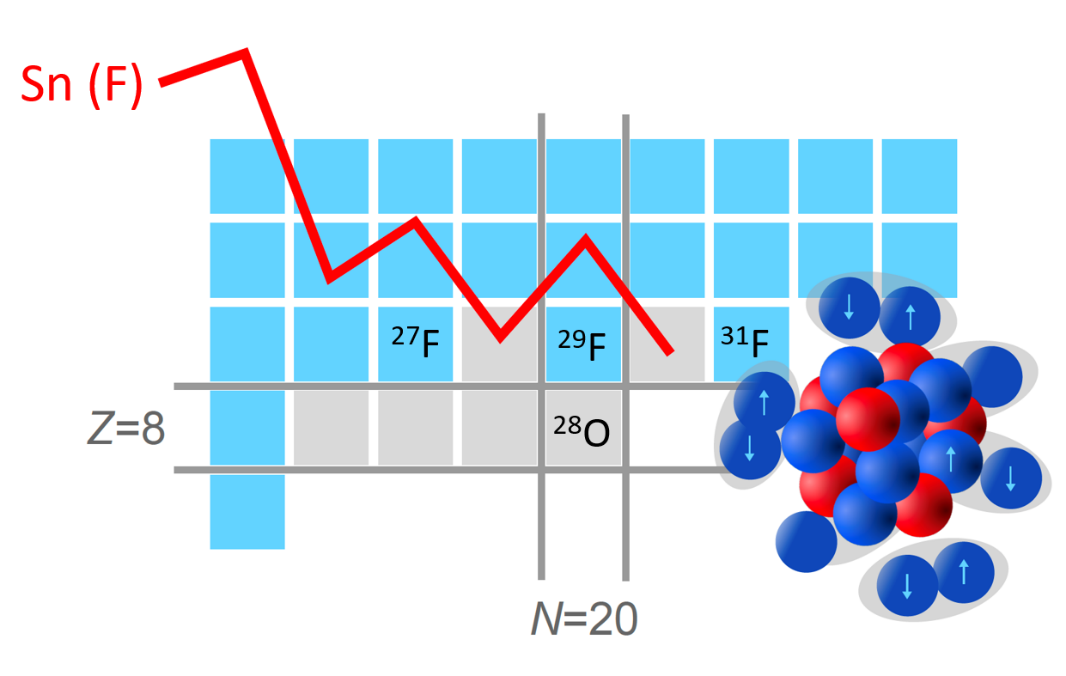
Gráfico mostrando a variação da energia de separação (Sn) do último neutrão dos isótopos de flúor. As oscilações da curva devem-se ao fato de que, como os neutrões evoluem aos pares, essa energia é sistematicamente superior nos isótopos contendo um número par de neutrões do que nos que contêm um número ímpar: arrancar um neutrão isolado requer menos energia. Entre o flúor-29 e o flúor-30, pode-se observar que essas oscilações permanecem constantes. Isso prova que as orbitais de neutrões estão bem emaranhadas. A presença do número mágico N=20 teria causado uma queda da Sn entre o flúor-29 e o flúor-30.
Mas as surpresas não param por aí. Se esta é a primeira vez que um regime de superfluidez foi observado em núcleos exóticos, os cientistas também puderam fazer outra constatação intrigante.
“Até então, pensávamos que o emparelhamento dos neutrões num contexto de superfluidez só ocorria no núcleo atómico em grandes distâncias, quando os dois neutrões de um par se encontravam em regiões distantes do núcleo, continua Olivier Sorlin. No entanto, os modelos teóricos que reproduzem os resultados experimentais dos núcleos de flúor e oxigénio sugerem que os pares de neutrões estão muito mais próximos. Se este resultado for confirmado por novas experiências mais específicas, previstas pela colaboração SAMURAI, isso mudaria completamente o entendimento da superfluidez."
Compreende-se, então, que com esta aparição inesperada da superfluidez em vez da magicidade, a colaboração SAMURAI abriu caminho a uma nova e empolgante aventura científica.