🧠 Uma proteína que rejuvenesce o cérebro? A descoberta que muda tudo
Publicado por Cédric,
Autor do artigo: Cédric DEPOND
Fonte: Science Advances
Outras Línguas: FR, EN, DE, ES
Autor do artigo: Cédric DEPOND
Fonte: Science Advances
Outras Línguas: FR, EN, DE, ES
O envelhecimento cerebral segue uma lógica implacável. Com o tempo, as células-tronco neurais (CTN) – essas preciosas células capazes de se transformar em neurônios funcionais – entram progressivamente em dormência. É como se elas se aposentassem após décadas de bons e leais serviços. Esta parada é inevitavelmente acompanhada por um declínio nas capacidades cognitivas, a memória e a aprendizagem tornando-se menos eficientes por falta de novos neurônios para renovar nossos circuitos cerebrais.
O detector de juventude celular
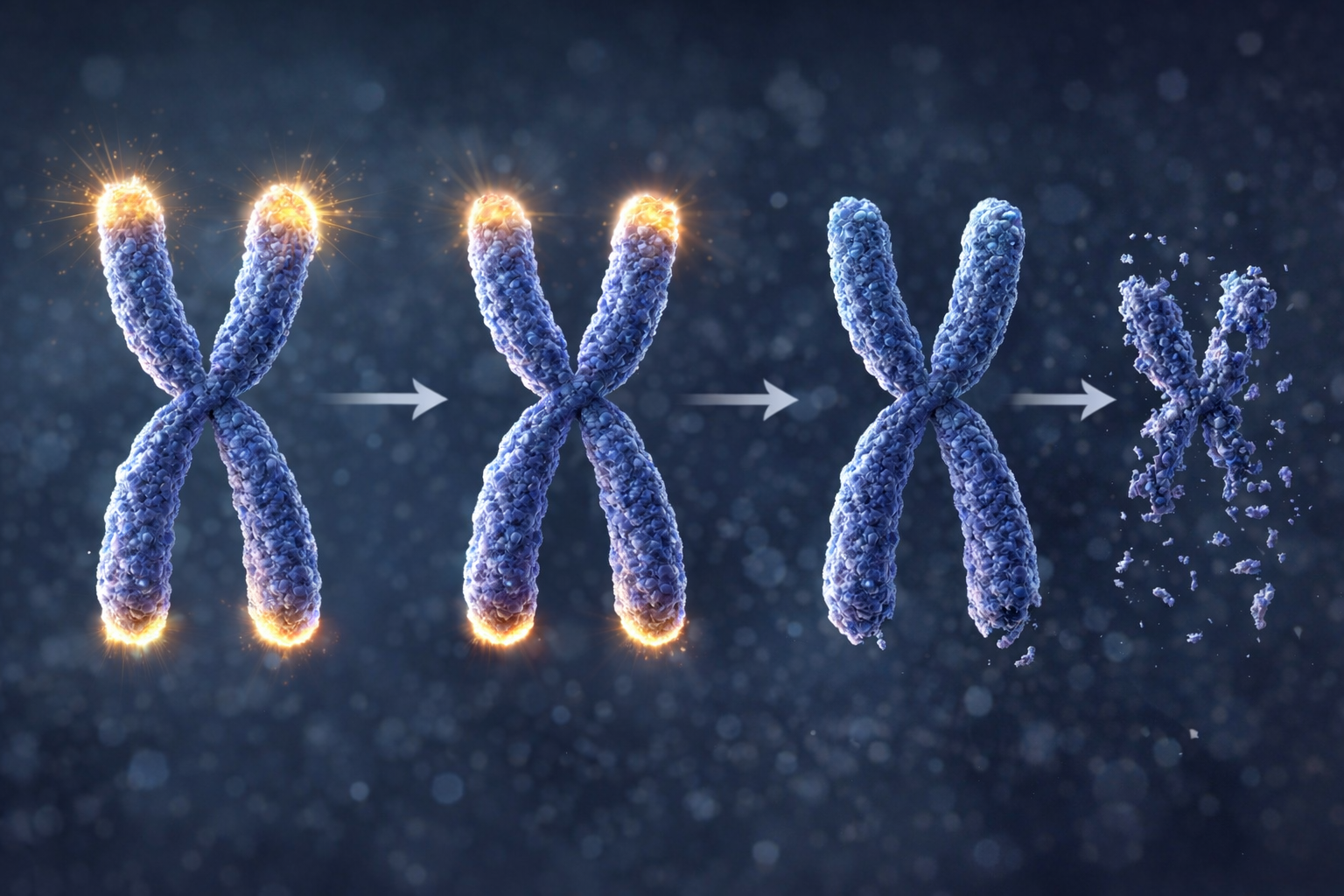
Para entender este fenômeno, é preciso interessar-se pelos telômeros, essas tampas protetoras localizadas nas extremidades de nossos cromossomos. A cada divisão celular, eles se desgastam um pouco mais, um processo comparável a um cadarço que se desfia gradualmente com o tempo. Quando este desgaste se torna excessivo, as células-tronco neurais perdem sua capacidade de se dividir e acabam morrendo ou se tornando senescentes. Esta erosão programada constitui um dos relógios fundamentais do envelhecimento cerebral.
A equipe da Universidade Nacional de Cingapura destacou o ator chave deste processo: a proteína DMTF1. Verdadeira maestrina genética, esta molécula age como um interruptor capaz de ativar ou desativar a expressão de certos genes. As análises revelaram sua presença abundante nas células-tronco neurais jovens, enquanto as células envelhecidas estão dramaticamente desprovidas dela. Esta correlação intrigou imediatamente os pesquisadores.
Em laboratório, os cientistas aumentaram artificialmente a quantidade de DMTF1 em células-tronco neurais envelhecidas, provenientes de modelos murinos e de culturas humanas. O resultado superou suas expectativas: a produção de novos neurônios retomou, como se o relógio biológico tivesse sido dado corda novamente. Fato notável, esta retomada ocorre sem que o comprimento dos telômeros seja restaurado, indicando que a DMTF1 usa uma via alternativa para contornar o problema.
As promessas e os limites terapêuticos
O mecanismo descoberto revela-se mais sutil do que uma simples reparação. A DMTF1 ativa dois genes auxiliares, chamados Arid2 e Ss18, que por sua vez estimulam outros genes envolvidos no crescimento celular. É uma cascata de ativação que permite reiniciar o ciclo de produção neuronal apesar do desgaste do DNA. Esta estratégia de contorno abre perspectivas terapêuticas totalmente novas.
Se o entusiasmo é legítimo, os pesquisadores apelam à maior prudência. Os experimentos foram conduzidos em laboratório com células e camundongos, não em humanos. O passo para uma aplicação clínica permanece imenso. Derrick Sek Tong Ong, químico biólogo que participou do estudo, insiste na necessidade de primeiro entender perfeitamente esses mecanismos antes de considerar qualquer intervenção terapêutica.
Um obstáculo maior se ergue no caminho das aplicações futuras: o risco cancerígeno. A DMTF1 estimula a divisão celular, e uma ativação descontrolada poderia favorecer o surgimento de tumores. As próximas etapas da pesquisa deverão portanto avaliar com extrema rigor as condições nas quais esta proteína poderia ser usada com segurança. O equilíbrio entre regeneração neuronal e proliferação anárquica deve ser determinado com precisão.
Para ir mais longe: O que são os telômeros e por que eles encurtam?
Veja os cadarços dos seus sapatos. Em cada extremidade, uma pequena ponteira de plástico impede o cadarço de desfiar. Em nossas células, os telômeros desempenham exatamente este papel. São tampas protetoras localizadas nas extremidades de nossos cromossomos, esses longos filamentos que contêm nosso DNA, o precioso manual de instruções do nosso corpo. Sem essas proteções, nosso material genético se estragaria a cada uso.
Cada vez que uma célula se divide para criar uma nova, ela deve copiar a integralidade de seu DNA. Mas este processo de cópia é imperfeito: a pontinha final do cromossomo não é copiada. Resultado: os telômeros encurtam levemente a cada divisão, como uma vela que queima e diminui cada vez que é acesa. Quanto mais uma célula viveu e se dividiu, mais curtos são seus telômeros.
Quando os telômeros se tornam muito curtos, eles não podem mais proteger eficazmente o DNA. A célula recebe então um sinal de alarme: ela cessa de se dividir, entra em senescência (um estado de "aposentadoria" forçada) ou morre. É por isso que as células acabam se esgotando com a idade: elas atingiram o limite de seu "contador" de divisões. Este mecanismo age como um relógio biológico, uma das causas fundamentais do envelhecimento de nossos tecidos.