🧠 Une protéine qui rajeunit le cerveau ? La découverte qui change tout
Publié par Cédric,
Auteur de l'article: Cédric DEPOND
Source: Science Advances
Autres langues: EN, DE, ES, PT
Auteur de l'article: Cédric DEPOND
Source: Science Advances
Autres langues: EN, DE, ES, PT
Restez toujours informé: suivez-nous sur Google Actualités (icone ☆)
Le vieillissement cérébral suit une logique implacable. Avec le temps, les cellules souches neurales (CSN) – ces précieuses cellules capables de se transformer en neurones fonctionnels – entrent progressivement en dormance. C'est comme si elles prenaient leur retraite après des décennies de bons et loyaux services. Cette mise à l'arrêt s'accompagne inévitablement d'un déclin des capacités cognitives, la mémoire et l'apprentissage devenant moins performants faute de nouveaux neurones pour renouveler nos circuits cérébraux.
Le détecteur de jeunesse cellulaire
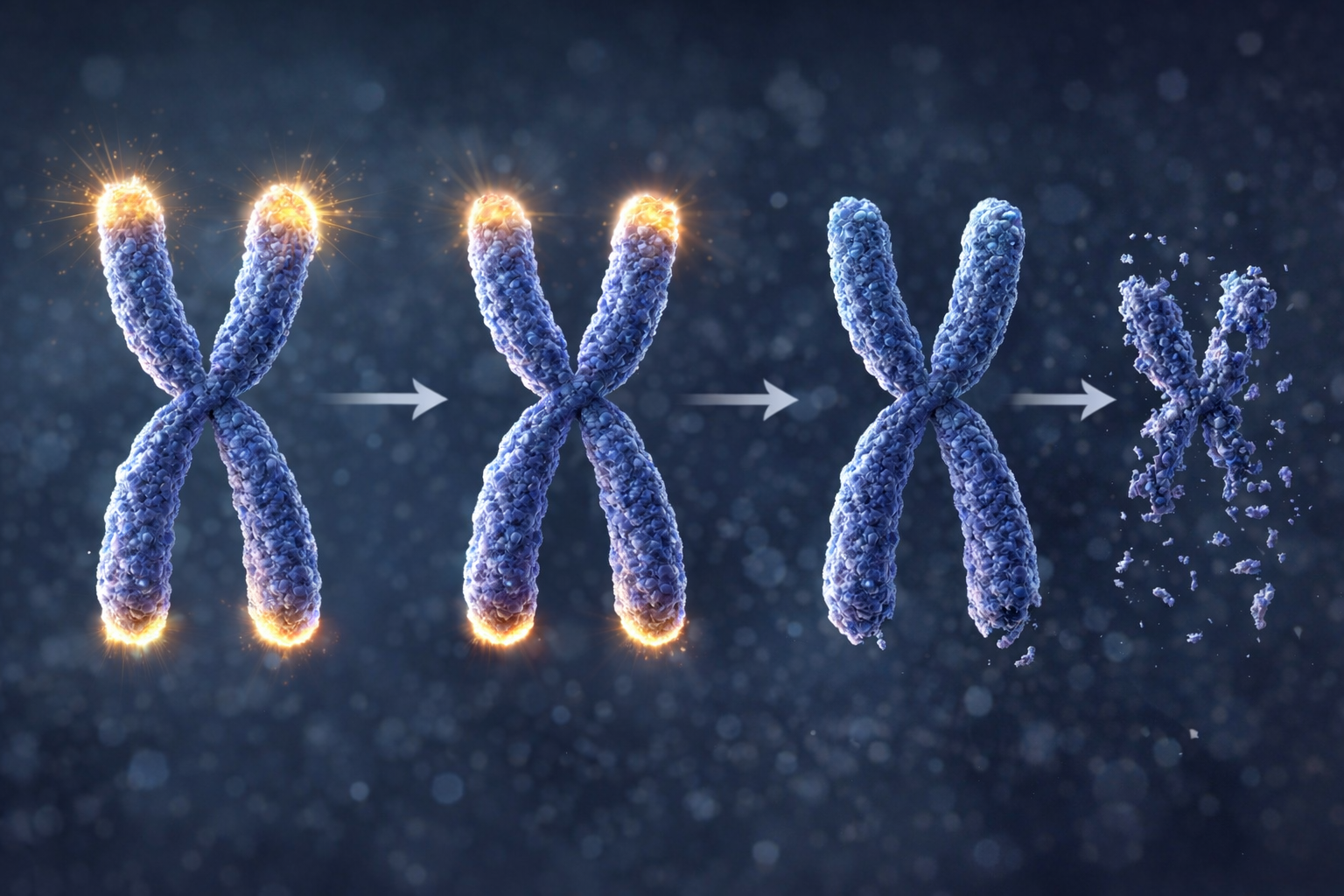
Pour comprendre ce phénomène, il faut s'intéresser aux télomères, ces capuchons protecteurs situés aux extrémités de nos chromosomes. À chaque division cellulaire, ils s'usent un peu plus, un processus comparable à un lacet qui s'effiloche progressivement avec le temps. Quand cette usure devient trop importante, les cellules souches neurales perdent leur capacité à se diviser et finissent par mourir ou devenir sénescentes. Cette érosion programmée constitue l'une des horloges fondamentales du vieillissement cérébral.
L'équipe de l'Université nationale de Singapour a mis en évidence l'acteur clé de ce processus: la protéine DMTF1. Véritable chef d'orchestre génétique, cette molécule agit comme un interrupteur capable d'activer ou de désactiver l'expression de certains gènes. Les analyses ont révélé sa présence abondante dans les cellules souches neurales jeunes, tandis que les cellules âgées en sont dramatiquement dépourvues. Cette corrélation a immédiatement intrigué les chercheurs.
En laboratoire, les scientifiques ont artificiellement augmenté la quantité de DMTF1 dans des cellules souches neurales vieillissantes, issues de modèles murins et de cultures humaines. Le résultat a dépassé leurs attentes: la production de nouveaux neurones a repris, comme si l'horloge biologique avait été remontée. Fait remarquable, cette relance s'opère sans que la longueur des télomères ne soit restaurée, indiquant que DMTF1 utilise une voie alternative pour contourner le problème.
Les promesses et les limites thérapeutiques
Le mécanisme découvert s'avère plus subtil qu'une simple réparation. DMTF1 active deux gènes auxiliaires, nommés Arid2 et Ss18, qui à leur tour stimulent d'autres gènes impliqués dans la croissance cellulaire. C'est une cascade d'activation qui permet de redémarrer le cycle de production neuronale malgré l'usure de l'ADN. Cette stratégie de contournement ouvre des perspectives thérapeutiques totalement nouvelles.
Si l'enthousiasme est légitime, les chercheurs appellent à la plus grande prudence. Les expériences ont été menées en laboratoire sur des cellules et des souris, pas sur des humains. Le pas vers une application clinique reste immense. Derrick Sek Tong Ong, chimiste biologiste ayant participé à l'étude, insiste sur la nécessité de comprendre d'abord parfaitement ces mécanismes avant d'envisager toute intervention thérapeutique.
Un obstacle majeur se dresse sur la route des applications futures: le risque cancéreux. DMTF1 stimule la division cellulaire, et une activation incontrôlée pourrait favoriser l'émergence de tumeurs. Les prochaines étapes de la recherche devront donc évaluer avec une extrême rigueur les conditions dans lesquelles cette protéine pourrait être utilisée sans danger. L'équilibre entre régénération neuronale et prolifération anarchique doit être déterminée avec précision.
Pour aller plus loin: Que sont les télomères et pourquoi raccourcissent-ils ?
Voyez les lacets de vos chaussures. À chaque extrémité, un petit embout en plastique empêche le lacet de s'effilocher. Dans nos cellules, les télomères jouent exactement ce rôle. Ce sont des capuchons protecteurs situés aux extrémités de nos chromosomes, ces longs filaments qui contiennent notre ADN, le précieux manuel d'instructions de notre corps. Sans ces protections, notre matériel génétique s'abîmerait à chaque utilisation.
À chaque fois qu'une cellule se divise pour en créer une nouvelle, elle doit copier l'intégralité de son ADN. Mais ce processus de copie est imparfait: la toute fin du chromosome n'est pas recopiée. Résultat, les télomères raccourcissent légèrement à chaque division, telle une bougie qui brûle et diminue à chaque fois qu'on l'allume. Plus une cellule a vécu longtemps et s'est divisée souvent, plus ses télomères sont courts.
Quand les télomères deviennent trop courts, ils ne peuvent plus protéger efficacement l'ADN. La cellule reçoit alors un signal d'alarme: elle cesse de se diviser, entre en senescence (un état de "retraite" forcée), ou meurt. C'est pourquoi les cellules finissent par s'épuiser avec l'âge: elles ont atteint la limite de leur "compteur" de divisions. Ce mécanisme agit comme une horloge biologique, l'une des causes fondamentales du vieillissement de nos tissus.