🔬 Vírus da raiva: como um vírus tão reduzido pode dominar uma célula humana?
Uma equipe de pesquisadores australianos identificou o mecanismo-chave utilizado pelo vírus da raiva. Seus trabalhos, publicados na Nature Communications, mostram que uma de suas proteínas, chamada P, desempenha um papel central. Essa proteína é capaz de realizar uma multidão de tarefas diferentes para tomar o controle da célula hospedeira, oferecendo assim uma explicação para a temível eficiência do vírus apesar de seu genoma mínimo.
A chave dessa versatilidade reside na capacidade da proteína P de modificar sua forma e se ligar ao RNA. O RNA é uma molécula fundamental em nossas células, responsável pelo transporte das informações genéticas e pela regulação de muitas atividades. Interagindo com ela, a proteína viral pode acessar diferentes compartimentos celulares e lá orquestrar processos essenciais, como a produção de proteínas ou a resposta imune.
Essa estratégia não seria exclusiva do vírus da raiva. Os cientistas pensam que outros agentes patogênicos muito perigosos, como os vírus Nipah e Ebola, poderiam empregar uma abordagem similar. Se essa hipótese se confirmar, isso abriria caminho para o desenvolvimento de tratamentos inovadores visando bloquear esse mecanismo comum, potencialmente eficaz contra várias doenças virais.
As descobertas deste estudo questionam o modelo tradicional das proteínas multifuncionais. Antes, imaginava-se que elas eram como trens onde cada vagão tinha uma função específica. Agora, parece que suas capacidades também emergem da maneira como suas partes interagem e se dobram para criar diferentes formas globais, uma flexibilidade que lhes permite adquirir novas propriedades, como a ligação ao RNA.
Essa flexibilidade estrutural constitui a arma suprema do vírus. Mudando de forma e se ligando ao RNA, a proteína P pode navegar entre diferentes fases físicas dentro da célula, infiltrando-se em zonas líquidas que controlam funções-chave (veja a explicação no final do artigo). Essa adaptação permite que ela transforme a célula em uma fábrica de vírus altamente produtiva, enquanto neutraliza suas defesas.
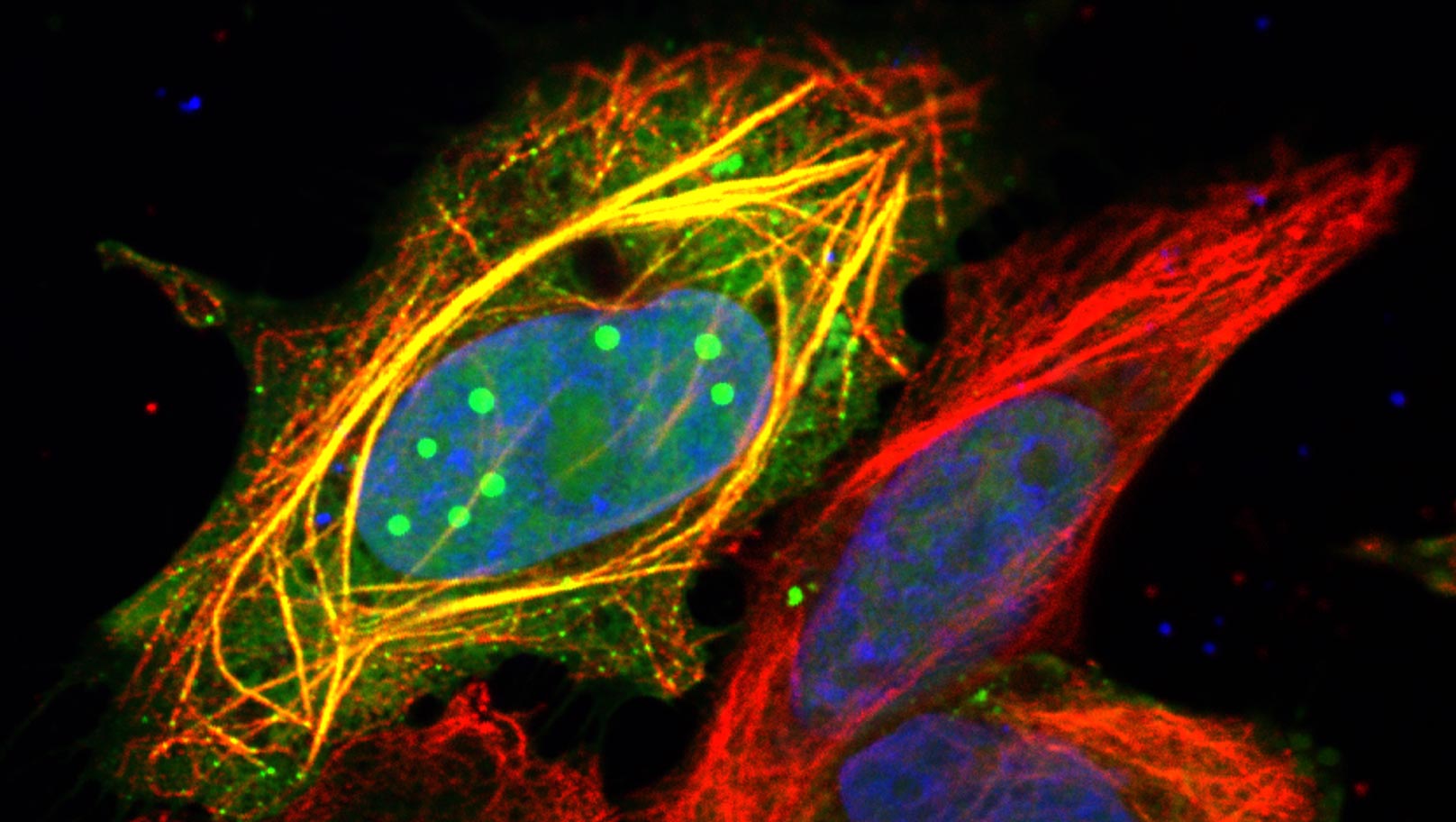
Imagem de microscopia confocal de células humanas mostrando a proteína P3 do vírus da raiva (em verde) formando gotículas dentro do núcleo (azul) e se ligando à rede de microtúbulos (vermelho).
Crédito: Stephen Rawlinson, Monash University
A compreensão desse novo mecanismo oferece perspectivas promissoras para o projeto de antivirais ou vacinas. Mirando na capacidade da proteína viral de mudar de forma ou interagir com o RNA, seria possível perturbar seu funcionamento e impedir a infecção. Esse avanço, fruto de uma colaboração entre várias instituições australianas, poderia assim modificar duravelmente nossa abordagem para combater algumas das infecções virais mais temíveis.
A organização em fases líquidas dentro das células
As células não são sacos homogêneos, mas contêm muitos compartimentos especializados, dos quais alguns se comportam como líquidos. Esses condensados biomoleculares, ou organelas sem membrana, se formam por um processo chamado separação de fases líquido-líquido. Moléculas específicas, como proteínas e RNA, se concentram ali para criar microambientes onde reações biológicas importantes acontecem.
Essas gotículas líquidas regulam atividades essenciais, como a fabricação de proteínas nos ribossomos, o processamento do RNA no nucléolo, ou a resposta ao estresse celular. Sua formação e dissolução são dinâmicas, permitindo que a célula se adapte rapidamente às mudanças. Essa organização facilita a eficiência dos processos ao aproximar os atores moleculares necessários.
Os vírus evoluíram para explorar essa arquitetura celular. Ligando-se ao RNA e mudando de forma, proteínas virais como a proteína P da raiva podem penetrar nesses compartimentos líquidos. Uma vez dentro, elas desviam suas funções para o benefício da replicação viral, por exemplo, perturbando a produção de proteínas celulares ou escapando dos mecanismos de defesa.
O estudo dessas interações abre um campo de pesquisa para entender não apenas as infecções, mas também certas doenças onde a separação de fases está desregulada, como em alguns transtornos neurológicos. Mirando na capacidade dos vírus de infiltrar essas zonas, poder-se-ia desenvolver medicamentos que protejam a integridade dos compartimentos celulares e limitem a propagação dos agentes patogênicos.