Hormone: le code secret de l'oestradiol
Publié par Adrien,
Source: CNRS-INSBAutres langues:
Source: CNRS-INSBAutres langues:
1
Restez toujours informé: suivez-nous sur Google Actualités (icone ☆)
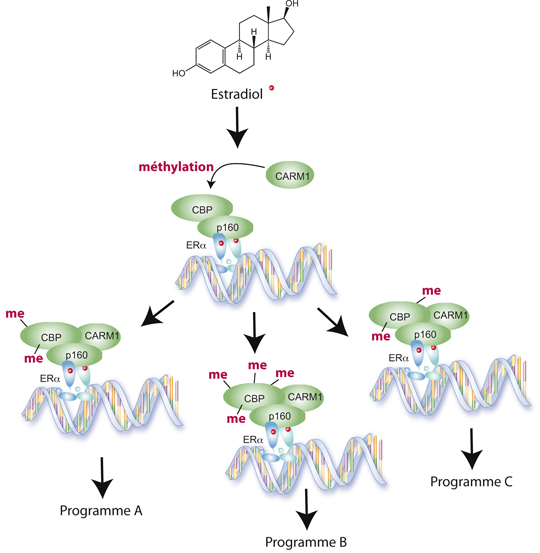
La fixation de l'oestradiol à un récepteur à oestrogènes (ER?) localisé sur la double hélice d'ADN, induit un changement structural qui permet le recrutement de coactivateurs (p160), puis des enzymes épigénétiques CBP et CARM1. CARM1 méthyle CBP sur plusieurs sites. En fonction de la configuration de ces méthylations, différents programmes génétiques sont mis en marche. © IGBMC, Hinrich Gronemeyer, CBD, Laurence Vandel
L'oestradiol fait partie des hormones oestrogènes sécrétées par les ovaires. Impliquée dans le développement sexuel des femmes, cette hormone aurait également un rôle non négligeable dans la cancérogénèse. En effet, l'oestradiol agit comme un facteur de croissance dans les cancers du sein à récepteurs d'oestrogènes positifs, ce qui explique pourquoi la thérapie antihormonale est fréquemment utilisée avec de bons résultats. Mais comment une simple molécule d'oestrogène peut-elle être responsable de changements physiologiques si importants et diversifiés ? Nombreuses sont les équipes scientifiques qui tentent depuis plusieurs années de répondre à cette question en décryptant les mécanismes d'action de cette molécule.
L'oestradiol agit sur l'ADN en s'y fixant grâce à un récepteur nucléaire qui possède à la fois un domaine de liaison à l'hormone et un domaine de liaison à l'ADN. La fixation de l'hormone à son récepteur induit un changement structural qui permet le recrutement de coactivateurs transcriptionnels. Ces derniers recrutent à leur tour deux enzymes épigénétiques, CARM1 et CBP, responsables de la sélection des gènes qui seront actifs ou non. Ce mécanisme était jusque-là bien connu. En revanche, pourquoi et comment des programmes génétiques totalement différents sont déclenchés restait une énigme. Des travaux conjoints entre les équipes d'Hinrich Gronemeyer à l'IGBMC et de Laurence Vandel au CBD ont récemment apporté de nouveaux éléments de compréhension sur l'action différenciée de l'oestradiol.
Alors que le groupe de Laurence Vandel a déjà montré que l'enzyme CARM1 active la transcription des gènes cibles en modifiant, par méthylation, l'enzyme CBP (*), les chercheurs de l'IGBMC et du CBD démontrent aujourd'hui que différentes combinaisons de formes méthylées de CBP sont recrutées au niveau de répertoires de gènes distincts dans les cellules de cancer du sein. Ces résultats suggèrent l'existence d'un "code" qui permettrait d'interpréter la forme méthylée de l'enzyme CBD et d'initier un sous-programme génétique spécifique. Un tel code de modification post-traductionnel a d'ailleurs déjà été mis en évidence pour les histones, protéines qui structurent l'ADN ; c'est le fameux "code des histones". Dans le cas de l'oestradiol, le fait que CBP soit un suppresseur de tumeurs et que CARM1 soit dérégulé dans certains cancers laisse penser que des modifications du code de méthylation de CBP pourraient être impliquées dans la tumorigénèse et/ou la progression tumorale.
Ces résultats identifient la régulation croisée entre les deux enzymes épigénétiques CARM1 et CBP comme un pivot de la réponse aux oestrogènes. Ils révèlent pour la première fois comment une petite molécule, en facilitant la communication entre un récepteur et des enzymes de modification épigénétiques, peut réguler des réseaux géniques bien distincts.