Restez toujours informé: suivez-nous sur Google Actualités (icone ☆)
Illustration: Techno-science.net
La progression épidémique du diabète est un fléau mondial. Selon l'Organisation mondiale de la santé, plus de 350 millions de personnes sont actuellement diabétiques dans le monde. En France, le nombre de personnes atteintes du diabète s'élèverait à plus de 3,5 millions. Le diabète se caractérise par un excès chronique de sucre dans le sang (hyperglycémie), ce qui, à long terme, peut entraîner de graves complications cardiovasculaires.
Le but des traitements antidiabétiques consiste à réduire la concentration en glucose dans le sang (glycémie) jusqu'à des valeurs normales. En conséquence, une meilleure connaissance des mécanismes de la régulation de la glycémie est indispensable pour établir de nouvelles stratégies thérapeutiques notamment pour les patients diabétiques réfractaires aux traitements traditionnels.
Marc Foretz et ses collègues avaient montré que l'ablation de la protéine kinase LKB1 spécifiquement dans le foie provoque une augmentation de la production de glucose dans les hépatocytes in vitro et une hyperglycémie in vivo. La protéine LKB1 est une kinase activatrice qui régule le métabolisme et la croissance cellulaire via l'activation de l'AMPK (AMP-activated protein kinase) et de 12 autres protéines kinases apparentées. Les chercheurs avaient montré que la modulation de l'activité de l'AMPK n'a pas de conséquence directe sur la production de glucose dans le foie. L'identité d'une autre protéine kinase en aval de LKB1 contrôlant la production de glucose restait donc à découvrir.
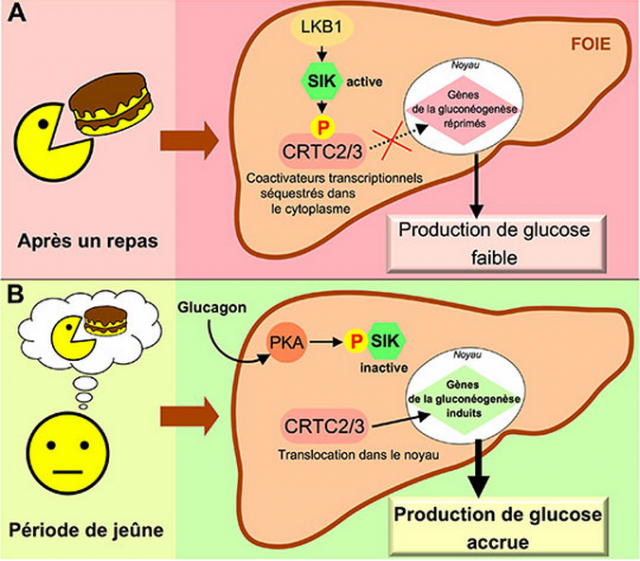
(A) En période postprandiale, les protéines kinases SIK sont activées de manière constitutive par la protéine LKB1 dans le foie. Les protéines SIK phosphorylent les coactivateurs transcriptionnels CRTC2/3 qui se retrouvent séquestrés dans le cytoplasme. Dans ces conditions, la transcription des gènes de la gluconéogenèse est réprimée, et la production hépatique de glucose est inhibée.
(B) Au cours d'un jeûne prolongé, l'augmentation de la concentration de glucagon dans le sang active la protéine kinase PKA via l'AMPc dans le foie. La PKA phosphoryle et inactive les protéines kinases SIK. Les facteurs CTRC2/3 ne sont alors plus phosphorylés et sont transloqués dans le noyau pour induire l'expression des gènes de la gluconéogenèse, conduisant à une augmentation de la production de glucose dans le foie.
Illustration: CNRS/Marc Foretz
La nouvelle étude de l'équipe de Marc Foretz, et de leurs collaborateurs de l'Université de Dundee (Ecosse), démontre que les salt-inductible kinases (SIK1, 2 et 3), des protéines kinases apparentées à l'AMPK, jouent un rôle clé en aval de LKB1 pour réprimer la voie de synthèse de glucose endogène (gluconéogenèse) dans le foie. L'inhibition pharmacologique spécifique des SIK conduit à la déphosphorylation des coactivateurs transcriptionnels CRTC2/3 entraînant une augmentation de l'expression des gènes de la gluconéogenèse et une production de glucose accrue dans les hépatocytes.
Les chercheurs prouvent que cette inhibition est mise en jeu au cours des périodes de jeûne afin de maintenir la glycémie. En effet, l'augmentation du glucagon dans la circulation active dans le foie la protéine kinase PKA qui va inactiver par phosphorylation les SIK, ce qui permet de lever l'inhibition de la voie gluconéogénique. De plus, bien que l'isoforme SIK2 ait été décrite comme un régulateur clé dans l'inhibition de la gluconéogenèse en réponse à l'insuline, ils prouvent génétiquement que l'ablation de SIK2 spécifiquement dans le foie n'a pas d'effet sur la gluconéogenèse, et que l'insuline ne module pas l'activité de SIK2.
Les résultats de ce travail démontrent que la voie LKB1-SIK réprime de manière constitutive la gluconéogenèse hépatique. Marc Foretz estime que ce nouveau mécanisme de régulation de la production de glucose dans le foie pourrait être impliqué dans la pathogenèse du diabète de type 2. En effet, une réduction de l'activité des SIK pourrait contribuer à l'augmentation de la glycémie observée dans le diabète. Inversement, l'activation ou la réactivation des SIK pourrait améliorer l'hyperglycémie chez les patients diabétiques, et ainsi constituer de nouvelles cibles pour le traitement du diabète de type 2.