Restez toujours informé: suivez-nous sur Google Actualités (icone ☆)
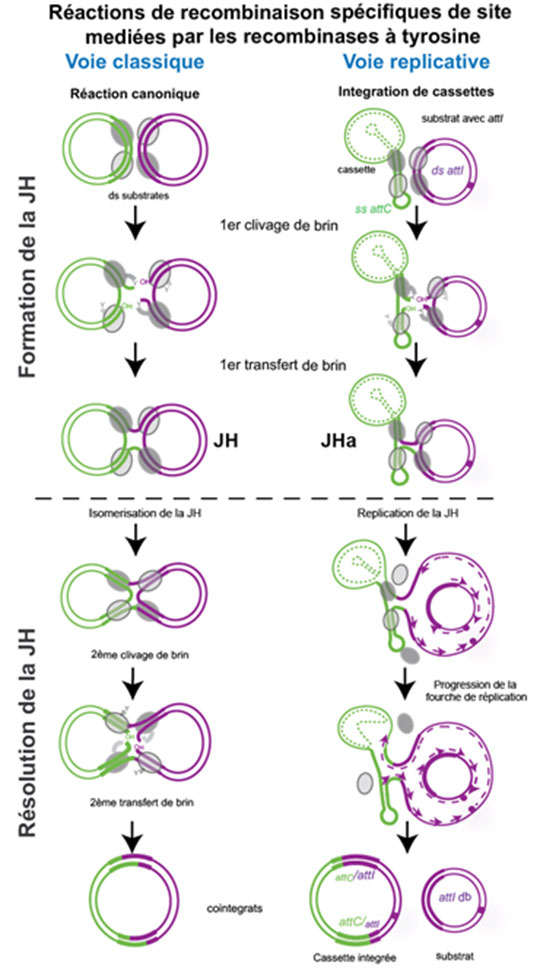
Figure: Les recombinases à tyrosine délivrent des réactions de recombinaison spécifiques de site par ce qu'on appelle "la voie classique". Cette voie consiste en un premier échange de brins et la formation de la jonction de Holliday (JH), suivie d'un deuxième échange de brins. Les intégrases des intégrons ont évolué pour reconnaître des substrats ADN simple brin, les recombiner avec des substrats ADN double brin, et résoudre cette jonction de Holliday asymétrique (JHa) par une étape de réplication ("voie réplicative"), évitant ainsi de linéariser le chromosome. Dans cette étude, les auteurs démontrent que les intégrases sont encore capables de réaliser une résolution classique quand les deux substrats sont double brin.
© Didier Mazel. Nature publishing group avec permission de reproduire.
En évolution, l'innovation, qui est définie comme le gain d'une fonction qualitativement différente de celle existante, diffère de l'adaptation, qui consiste à l'amélioration d'une fonction existante. Les mécanismes sous-jacents à l'adaptation, comme l'origine de la variabilité et la sélection naturelle des allèles mieux adaptés, sont bien connus. Par contre, l'innovation est bien moins comprise car elle entraine souvent des changements radicaux qui peuvent mener à une perte de la fonction initiale et donc l'élimination de l'élément innovateur par sélection naturelle.
Les intégrases des intégrons (Eléments génétiques impliqués dans la capture de gènes lors des transferts génétiques horizontaux entre bactéries) forment un groupe de recombinases à tyrosine qui catalysent la réaction d'intégration d'un type d'élément génétique mobile nommé cassette de gène. Ces cassettes codent des gènes qui permettent aux bactéries contenant des intégrons d'évoluer rapidement et de s'adapter à des environnements changeants. Leur succès évolutif se reflète dans leur rôle prépondérant pour l'apparition et le développement de la multirésistance aux antibiotiques chez les bactéries à Gram négatif.
La réaction d'intégration des cassettes est un exemple d'innovation moléculaire. Il y a quelques centaines de millions d'années, ces intégrases ont acquis un segment peptidique d'environ 20 acides aminés au sein de leur domaine catalytique, qui leur permet de reconnaître les sites de recombinaison dans les cassettes (attC). Ces sites, qui forment des épingles à cheveux d'ADN simple brin, sont structurellement différents des sites canoniques des autres recombinases. Les intégrases reconnaissent ces sites par leur structure secondaire, et non par leur séquence. En outre, pour éviter de linéariser le chromosome bactérien, la jonction de Holliday qui est créée par l'intégrase lors de l'intégration d'une cassette, et résolue d'une façon unique, spécifique des intégrons. Avec de tels changements - de telles innovations - pour réaliser cette nouvelle réaction, on se serait attendu à ce que l'intégrase ait perdu son activité ancestrale. Cependant, le site d'intégration des cassettes dans l'intégron (attI) a une structure canonique et sa reconnaissance par l'intégrase semble se faire par sa séquence, de façon plus classique. Les chercheurs démontrent que la voie de résolution ancestrale peut encore prendre place quand les deux substrats de la réaction sont des sites attI, une réaction dont la valeur adaptative est inconnue et qui a lieu à des fréquences extrêmement faibles. Ceci démontre que l'intégrase a conservé son activité ancestrale et prouve que l'innovation vers son nouveau mode de recombinaison permettant la recombinaison des cassettes simple brin d'ADN a pu se faire sans à-coups, en conservant l'activité originale sur les substrats canoniques, et l'innovation vers ses nouveaux substrats.
Les équipes de Didier Mazel et Vincent Parissi sont associées au sein du GDR 3546 " "Eléments Génétiques Mobiles: du mécanisme aux populations, une approche intégrative".