Un cheval de Troie pour rendre le foetus hémophile A tolérant au facteur VIII thérapeutique
Publié par Adrien,
Source: CNRS-INSBAutres langues:
Source: CNRS-INSBAutres langues:
2
Restez toujours informé: suivez-nous sur Google Actualités (icone ☆)
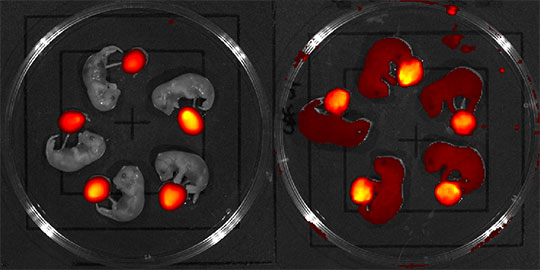
Figure 1: Transfert materno-foetal chez la souris du domaine C2 du facteur VIII fusionné au fragment Fc des immunoglobulines G. Le C2-Fc fluorescent a été injecté dans le sang de souris gestantes sauvages ou de souris n'exprimant pas le récepteur Fc néonatal (FcRn). La présence du C2-Fc dans le placenta et les foetus a ensuite été détectée par imagerie in vivo. Le C2-Fc s'accumule dans le placenta de tous les bébés. En revanche, il n'est retrouvé que chez les foetus des souris sauvages (à droite), et pas chez les foetus de souris déficientes pour les FcRn (à gauche).
Une réponse immunitaire peut survenir contre certaines protéines thérapeutiques. C'est le cas des patients atteints de maladies génétiques telles que l'hémophilie A, l'hémophilie B, la maladie de Willebrand ou la maladie de Pompe, lorsqu'ils sont traités avec du facteur VIII, du facteur IX, du facteur Willebrand ou de l'alpha-glucosidase. L'apparition d'anticorps neutralisant les protéines thérapeutiques représente une impasse thérapeutique et un problème de santé publique. Dans de telles pathologies, l'induction d'une tolérance immunitaire aux protéines thérapeutiques in utero représenterait une avancée majeure pour améliorer la prise en charge clinique ultérieure des patients, leur qualité de vie et réduire les coûts sociétaux associés.
Des chercheurs du CNRS, de l'INSERM, et des universités Pierre et Marie Curie et Paris Descartes décrivent une nouvelle stratégie permettant de prévenir les réponses immunitaires anti-médicaments en induisant une tolérance centrale et périphérique pendant la vie foetale. Cette stratégie exploite le fait que les immunoglobulines G (IgG) maternelles sont transférées dans la circulation du foetus à travers le placenta par l'intermédiaire du récepteur Fc néonatal. Les résultats montrent que le transfert materno-foetal d'une protéine fusionnée au fragment Fc des IgG génère une tolérance spécifique et de longue durée chez les souris nouveau-nées. Cette tolérance est associée à une augmentation de cellules T régulatrices originaires du thymus et de la circulation périphérique spécifiques de la protéine administrée.
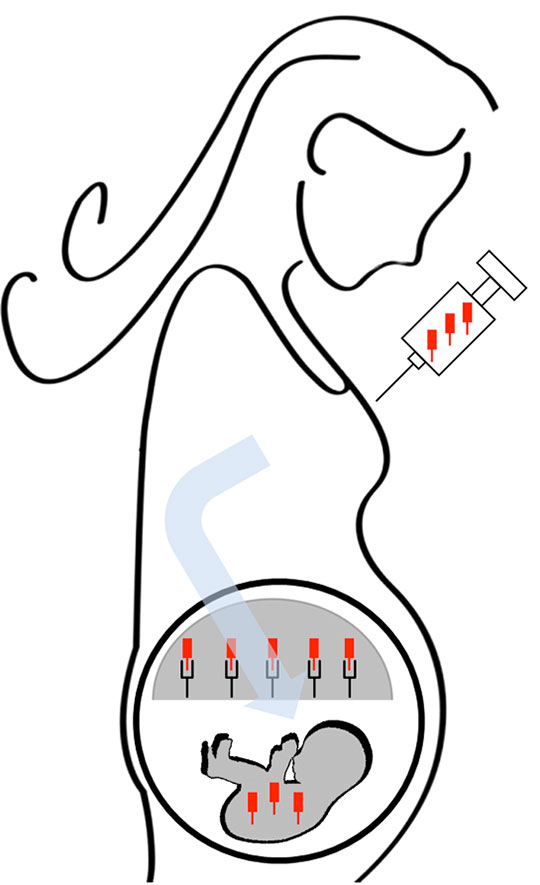
Figure 2: Translation potentielle de la stratégie chez l'homme. Les domaines immunodominants du facteur VIII sont fusionnés au fragment Fc de l'IgG1 humaine. Les protéines de fusion sont injectées dans le sang de la mère pendant la grossesse. En se liant au récepteur néonatal Fc présent sur le placenta, le fragment Fc permet le transfert des domaines du facteur VIII dans le sang du foetus. Le système immunitaire du foetus est alors "éduqué" dans le thymus: une tolérance spécifique du FVIII et dépendante des lymphocytes T régulateurs, est établie. Ainsi, le nouveau-né sera-t-il protégé contre l'apparition d'anticorps anti-facteur VIII lorsqu'il sera traité avec le facteur VIII thérapeutique.
©N Gupta et S Lacroix-Desmazes
Les chercheurs apportent ensuite une preuve de concept de la validité de leur approche à l'aide du modèle pré-clinique murin d'hémophilie A, une maladie hémorragique rare liée au chromosome X et consécutive à l'absence du facteur VIII de la coagulation. Le transfert placentaire de fragments de facteur VIII fusionnés au fragment Fc réduit de manière drastique la réponse neutralisante anti-facteur VIII chez les souriceaux lors de l'administration de FVIII thérapeutique à l'âge adulte (Figure 1).
L'hémophilie A est la maladie la plus appropriée pour envisager la translation de ces observations aux patients (Figure 2). En effet, la naissance d'un bébé hémophile A peut être anticipée sur la base d'une histoire familiale de la maladie, et confirmée grâce à des tests génétiques simples et précoces. De plus, le risque pour les patients hémophiles A de développer une réponse neutralisante anti-facteur VIII (jusqu'à 30% des patients) peut-être prédit de manière assez fiable. Enfin, un facteur VIII-Fc vient d'être approuvé aux Etats-Unis et devrait être prochainement disponible sur le marché européen.