Restez toujours informé: suivez-nous sur Google Actualités (icone ☆)

© Lionel Pintard & Nicolas Tavernier
L'entrée et la progression en mitose est orchestrée par une série de protéines kinases, notamment Aurora Kinase A (AURKA), Polo-like kinase 1 (Plk1) et Cycline B-Cdk1. Leur activation précise et coordonnée conduit à une augmentation massive de la phosphorylation du protéome ce qui entraîne une réorganisation drastique de l'architecture cellulaire, nécessaire à la ségrégation des chromosomes entre les deux cellules filles. Pour être activées, ces kinases nécessitent elles-mêmes d'être phosphorylées sur un résidu très conservé d'une région particulière appelée "boucle d'activation", ce qui permet de les stabiliser dans une conformation active, compatible avec la fixation de l'ATP et du substrat. Cette phosphorylation activatrice peut être apportée par auto-phosphorylation ou par une autre kinase. Ainsi, AURKA peut s'autophosphoryler sur sa boucle d'activation. En revanche, Plk1 est incapable de s'autophosphoryler et nécessite une phosphorylation activatrice par AURKA. Cette étape requiert également une protéine intrinsèquement désordonnée appelée Bora. Depuis sa découverte, il y a plus de 15 ans, le rôle exact exercé par Bora dans la phosphorylation de Plk1 par AURKA restait à découvrir.
En utilisant le nématode Cænorhabditis elegans comme système modèle, les chercheurs avaient auparavant montré que la phosphorylation de Bora est critique pour stimuler la phosphorylation de Plk1 par AURKA, et ainsi, déclencher l'entrée en mitose. Cette observation a par la suite été étendue aux cellules humaines et aux extraits d'oeufs de xénope. En particulier, la phosphorylation de Bora par les complexes Cycline A-Cdk1, qui sont spécifiquement activés en phase S/G2 du cycle cellulaire, est requise pour déclencher l'entrée en mitose dans les extraits d'oeuf de xénope. Restait alors à comprendre comment Bora phosphorylée par Cycline A-Cdk1 (dénommé par la suite phospho-Bora), stimulait la phosphorylation de Plk1 par AURKA. Divers modèles existaient dans la littérature mais le rôle exact de phospho-Bora demeurait énigmatique.
En utilisant une combinaison d'approches biochimiques, biophysiques et fonctionnelles, les chercheurs montrent que phospho-Bora exerce directement son action sur AURKA. De façon surprenante, phospho-Bora est un puissant activateur d'une forme d'AURKA dépourvue de sa phosphorylation activatrice et donc supposée inactive. Les chercheurs montrent que phospho-Bora, en interagissant avec AURKA, apporte en trans un phosphate qui vient se loger dans la boucle d'activation d'AURKA, et remplace ainsi le phosphate normalement apporté en cis, ce qui permet vraisemblablement de stabiliser la kinase dans sa configuration active. En accord avec cette hypothèse, le phosphate apporté par Bora interagit avec une constellation de résidus basiques situés dans la boucle d'activation d'AURKA, qui sont normalement impliqués dans l'interaction avec le phosphate apporté en cis. Ces travaux illustrent comment une kinase supposément inactive, car non phosphorylée, peut être activée par un cofacteur, apportant en trans le phosphate dans la boucle d'activation.
Quelle est la signification biologique de ces observations ? Lors de son expression en phase G2 du cycle cellulaire, AURKA est rapidement déphosphorylée sur sa boucle d'activation car, durant cette phase, les activités phosphatases prédominent. AURKA est donc maintenue sous forme inactive. Dans le même temps, Cycline A-Cdk1 phosphoryle Bora, qui peut alors apporter en trans le phosphate essentiel à l'activation d'AURKA. Ainsi activée, AURKA va promouvoir la phosphorylation et l'activation de Plk1 puis en cascade, celle de CyclinB-Cdk1 permettant ainsi l'entrée en mitose.
Ce mécanisme permet de coordonner les phases S/G2 et l'entrée en mitose. Bora agit donc comme une molécule signal qui couple l'activité des complexes Cycline A-Cdk1 à l'activation des kinases mitotiques. La mise en évidence de l'existence de différentes formes d'AURKA, régulées par divers mécanismes dans le temps et l'espace, pourrait ouvrir de nouvelles pistes dans le développement de stratégies anticancéreuses ciblées pour inactiver certaines fonctions d'AURKA.
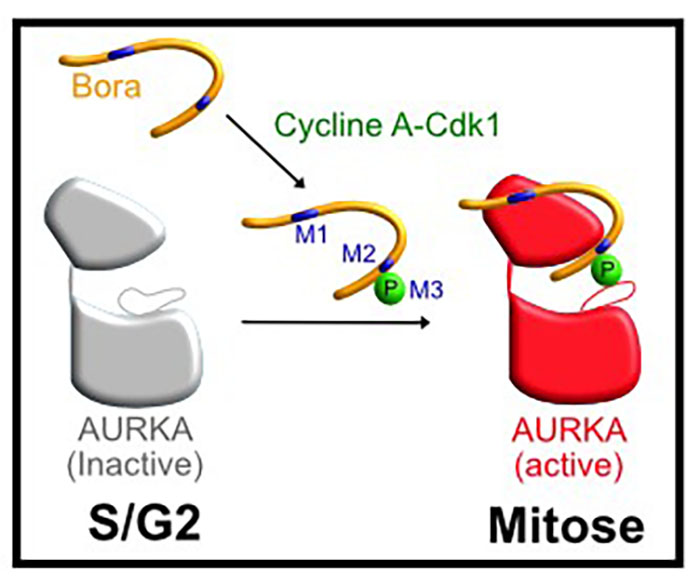
Figure: phospho-Bora active AURKA pour déclencher l'entrée en mitoseCycline A-Cdk1 phosphoryle Bora qui interagit ensuite avec AURKA déphosphorylée sur sa boucle d'activation via trois déterminants (M1, M2 et M3). Les motifs M1 et M2 correspondent à deux courtes séquences requises pour fixer AURKA. Le motif 3 (M3), situé juste après le motif M2, correspond à un site de phosphorylation par Cycline A-Cdk1, essentiel à la fonction de Bora. Ce motif M3, correspondant au phosphate de Bora, vient se positionner dans la boucle d'activation d'AURKA, permettant de stabiliser la kinase dans une forme active, requise pour déclencher l'entrée en mitose.
© Lionel Pintard & Nicolas Tavernier
Pour en savoir plus:
Bora phosphorylation substitutes in trans for T-loop phosphorylation in Aurora A to promote mitotic entry
Tavernier N, Thomas Y, Vigneron S, Maisonneuve P, Orlicky S, Mader P, Regmi SG, Van Hove L, Levinson NM, Gasmi-Seabrook G, Joly N, Poteau M, Velez-Aguilera G, Gavet O, Castro A, Dasso M, Lorca T, Sicheri F, Pintard L.
Nature Communications 26 mars 2021. doi: 10.1038/s41467-021-21922-w.
laboratoire:
Institut Jacques Monod (IJM) - (Université de Paris /CNRS) - Bâtiment Buffon, 15 rue Hélène Brion. - 75205 Paris cedex 13 France.
Contacts:
- Lionel Pintard - Chercheur CNRS à l'Institut Jacques Monod (IJM) - lionel.pintard at ijm.fr
- Nicolas Tavernier - Chercheur contractuel à l'Institut Jacques Monod (IJM) - nicolas.tavernier at ijm.fr