Restez toujours informé: suivez-nous sur Google Actualités (icone ☆)
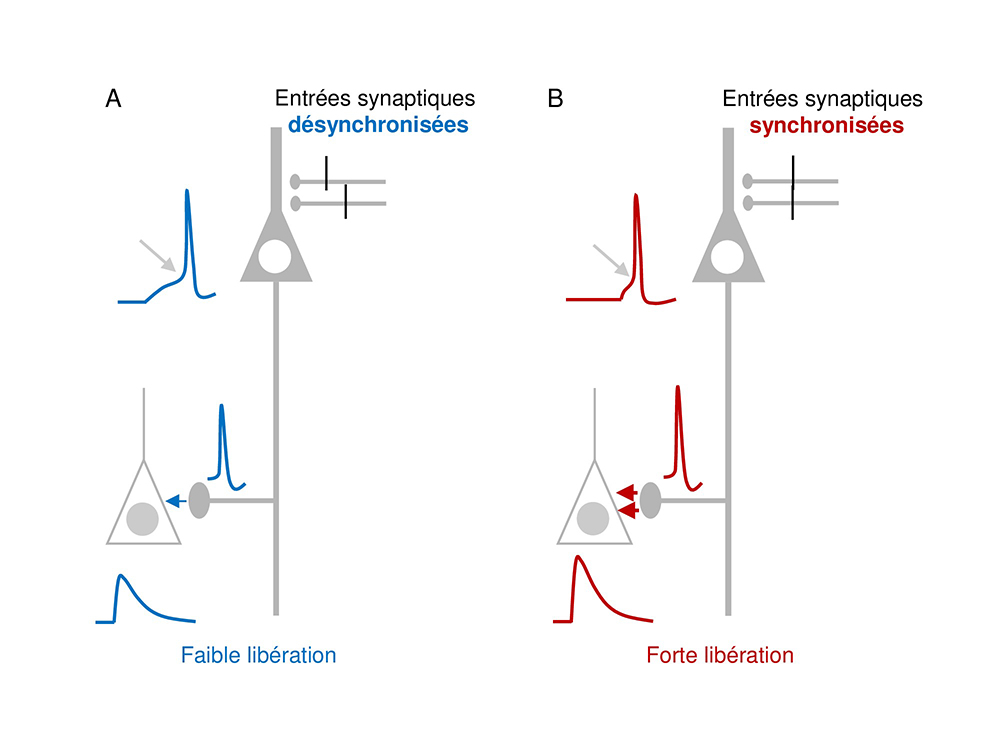
Principe de la facilitation de la transmission synaptique dépendant de la synchronisation des entrés synaptiques. Un neurone pyramidal (gris) reçoit des entrées synaptiques sur sa dendrite apicale et est connecté à un autre neurone (blanc) par une synapse via un axone.
A: cas où les entrées sont désynchronisées. Le potentiel d'action est déclenché avec un long délai (flèche oblique). Dans l'axone, le potentiel d'action est de faible amplitude (bleu). Il produit une faible libération de neurotransmetteur (flèche bleue) et une petite réponse synaptique.
B: cas où les entrées sont synchronisées. Le potentiel d'action est déclenché avec un délai court (flèche oblique). Dans l'axone, le potentiel d'action est de grande amplitude (rouge) ; il produit donc une forte libération de neurotransmetteur (flèches rouges) et une grande réponse synaptique.
© Dominique Debanne.
Les processus sensoriels comme la vision ou l'audition requièrent des mécanismes de détection ultrarapides (de l'ordre du millième de seconde) afin de discriminer les informations pertinentes codées par des entrées synaptiques fortement synchronisées de celles moins importantes et qui sont donc faiblement synchronisées. Jusqu'à présent, on pensait que cette discrimination était opérée par des mécanismes de détection de coïncidence au niveau post-synaptique comme l'activation des récepteurs NMDA (N-methyl-D-aspartate), l'amplification des potentiels postsynaptiques excitateurs ou l'adaptation du seuil du potentiel d'action qui dépend des canaux sodium localisés dans l'axone. Contrairement aux deux autres, ce dernier mécanisme est particulièrement bien adapté pour discriminer des évènements rapides. En effet, les canaux sodium qui régissent l'adaptation du potentiel d'action permettent une discrimination temporelle de l'ordre du millième de seconde en raison de leur cinétique d'ouverture et de fermeture rapide. Jusqu'à présent, on ignorait comment la lecture de la synchronisation était transmise aux autres neurones.
En théorie, la disponibilité des canaux sodium est maximale si le seuil du potentiel d'action est atteint de manière instantanée. Cette configuration correspondant à une inactivation minimale des canaux sodium peut être obtenue si le potentiel d'action présynaptique est déclenché par des entrées fortement synchronisées. Ainsi, en combinant l'enregistrement électrophysiologique de paires de neurones issus de tranches de cerveau de rat, l'imagerie du calcium, l'enregistrement simultané de l'axone et du corps cellulaire ainsi que la modélisation, les chercheurs ont identifié un nouveau mécanisme de transmission de la synchronisation.
Ils démontrent en effet que la transmission synaptique est facilitée quand le potentiel d'action présynaptique est généré par une entrée synchronisée avec une latence courte alors qu'elle est réduite lorsque le potentiel d'action est généré par une entrée désynchronisée avec plus longue latence. Cette facilitation dépendant de la synchronisation repose sur la modulation de l'amplitude du potentiel d'action axonal de plusieurs millivolts qui lui-même conditionne l'entrée de calcium dans la terminaison présynaptique. Il est intéressant de noter qu'en raison des propriétés différentes des canaux sodium dans les compartiments somatique et axonal, la modulation de l'amplitude du potentiel d'action n'est visible que dans l'axone mais pas dans le corps cellulaire. Cette facilitation est observée dans les circuits locaux du néocortex (entre cellules pyramidales de la couche 5) et de l'hippocampe (entre cellules pyramidales de CA3) et affecte l'activité propagée dans ces circuits locaux.
Cette étude fait tomber un dogme bien établi: le potentiel d'action n'est pas aussi stable qu'on le pensait mais il peut varier considérablement en amplitude en fonction des conditions dans lesquelles il est déclenché. De plus, les chercheurs pensent avoir identifié ici le premier substrat biologique du codage temporel par la latence absolue des potentiels d'action, le mode de codage neuronal considéré comme le plus puissant d'un point de vue théorique. Les propriétés des canaux sodium axonaux définissent une nouvelle forme de modulation de la transmission synaptique par laquelle le temps d'arrivée d'un potentiel d'action présynaptique devient un facteur critique dans la transmission de l'information neuronale dans le cortex. Il reste cependant encore bien des questions à explorer comme la généralisation de ce principe aux différents neurones et circuits du cerveau et sa vérification chez l'animal entier.
Pour en savoir plus:
Axonal Na+ channels detect and transmit levels of input synchrony in local brain circuits.
Zbili M, Rama S, Yger P, Inglebert Y, Boumedine-Guignon N, Fronzaroli-Molinieres L, Brette R, Russier M & Debanne D.
Science Advances 6 mai 2020. DOI: 10.1126/sciadv.aay4313
Laboratoire:
Unité de Neurobiologie des canaux Ioniques et de la Synapse (UNIS) - (Inserm/AMU)
51, Boulevard Pierre Dramard, 13015 Marseille.
Contact:
Dominique Debanne - Directeur de Recherche CNRS à l'Unité de Neurobiologie des canaux Ioniques et de la Synapse (UNIS)
dominique.debanne at inserm.fr