Restez toujours informé: suivez-nous sur Google Actualités (icone ☆)
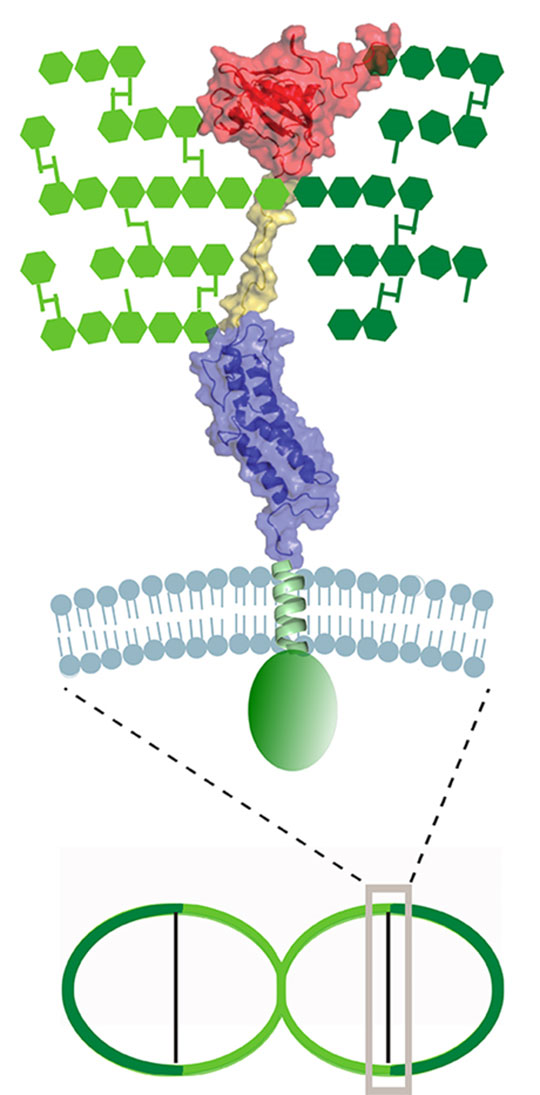
Figure: Organisation structurale de MapZ en deux domaines (bleu et rouge) séparés par un lien flexible (jaune) dans la paroi cellulaire du pneumocoque. MapZ est mécaniquement positionnée entre la paroi de la cellule mère (vert foncé) et celle nouvellement synthétisée (vert clair) donnant naissance aux cellules filles.
© Christophe Grangeasse. Jean-Pierre Simorre
La plupart des bactéries se divisent par fission binaire afin de donner naissance à deux cellules filles identiques. Pour cela, la machinerie protéique de division cellulaire doit être positionnée très précisément au centre de la cellule mère. Récemment, un processus inédit de régulation dans lequel la localisation de la machinerie de division est attirée au centre de la cellule par la protéine membranaire MapZ a été décrit . La protéine MapZ joue donc le rôle d'une balise moléculaire qui identifie de manière permanente le centre de la cellule. Néanmoins, le processus par lequel MapZ se positionne elle-même au centre de la cellule pour ensuite fixer la machinerie de division restait énigmatique.
Dans cette nouvelle étude, le groupe de Christophe Grangeasse de l'Unité Microbiologie Moléculaire et Biochimie Structurale à Lyon et le groupe de Jean-Pierre Simorre de l'Institut de Biologie Structurale à Grenoble, ont associé leurs efforts et leurs expertises pour réaliser une étude structure/fonction et comprendre le positionnement de MapZ au centre de la cellule au niveau moléculaire. La caractérisation structurale du domaine extracellulaire de MapZ par Résonnance Magnétique Nucléaire (RMN) a permis de démontrer l'existence de deux sous-domaines structurés et séparés par une région de liaison (linker) flexible. En utilisant des approches de microscopie de la cellule vivante et de biochimie des protéines, les chercheurs ont ensuite démontré que l'un des deux sous-domaines servait de piédestal au second pour que ce dernier puisse être correctement positionné grâce au linker flexible et ainsi interagir avec le peptidoglycane, le composant majeur de la paroi cellulaire responsable de l'élongation cellulaire. Une analyse plus précise du second sous-domaine a permis de caractériser une signature conservée et comprenant les acides aminés indispensables à l'interaction avec le peptidoglycane. MapZ est ainsi véhiculée par le peptidoglycane produit lors de l'allongement cellulaire. Lorsque l'allongement de la cellule mère est suffisant pour générer deux cellules filles, MapZ est donc mécaniquement positionnée au centre de la future cellule fille et peut alors jouer un rôle de balise moléculaire pour positionner la machinerie de division cellulaire.
Ce travail laisse entrevoir des retombées très intéressantes pour la lutte contre les maladies infectieuses d'origine bactérienne. En effet, ces travaux serviront de base fondamentale pour la conception rationnelle de molécules spécifiques empêchant MapZ d'interagir avec le peptidoglycane et limitant ainsi la multiplication des bactéries. Connaissant l'urgence en matière de découverte de nouveaux antibiotiques, la mise au point de molécules bloquant la protéine MapZ représenterait une avancée majeure vers la découverte de nouveaux antibiotiques et un exemple de valorisation d'une recherche fondamentale.