Maladies à prion: vers une réduction de l'expérimentation animale
Publié par Isabelle,
Source: INRAAutres langues:
Source: INRAAutres langues:
1
Restez toujours informé: suivez-nous sur Google Actualités (icone ☆)
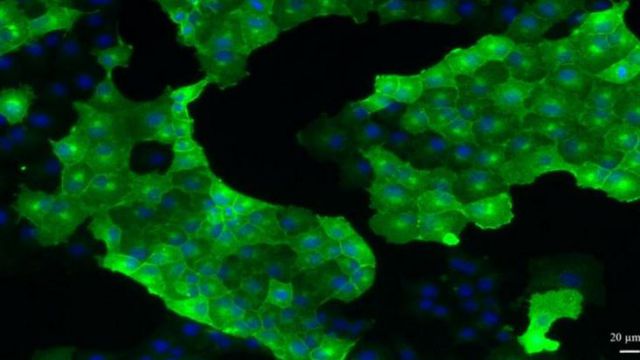
Cellules épithéliales de rein de lapin produisant la protéine prion normale d'une espèce au choix (en vert). Les noyaux des cellules sont marqués en bleu. Ces cellules sont utilisées pour la préparation d'extraits protéiques compétents pour amplifier le prion par la procédure décrite dans le présent travail.
© VIM, Inra Jouy-en-Josas, Jérôme Chapuis
Les maladies à prion touchent l'homme (Creutzfeldt-Jakob) ainsi que les animaux d'élevage (tremblante du mouton, vache folle) ou sauvages, avec une issue invariablement fatale. Responsables de ces pathologies, les prions sont des particules protéiques infectieuses (dépourvues d'acides nucléiques: ADN ou ARN). Tel un Dr Jekyll et Mr Hyde, la protéine du prion existe sous deux formes: une forme normale associée à des fonctions biologiques, et une forme mal repliée infectieuse. La propagation du prion se fait par contact de la forme anormale et de la forme normale. Ce contact induit un changement de l'architecture de la protéine normale qui se convertit en une nouvelle entité pathogène. Par un effet domino, ce phénomène se propage de proche en proche au sein du tissu nerveux et conduit à une mort neuronale qui entraîne l'apparition de "trous" dans le cerveau (spongiose).
Un nouveau système in vitro pour étudier le prion
La plupart des travaux menés sur le prion sont basés sur l'étude du pouvoir infectieux d'échantillons biologiques sur des animaux. L'inconvénient majeur de cette méthode est la durée d'incubation de la maladie qui, chez les rongeurs de laboratoire, varie entre 2 mois et 2 ans. De plus, ce type d'expérimentation requiert un grand nombre d'animaux. Il existe néanmoins quelques systèmes de cellules cultivées in vitro qui permettent l'étude des prions.
Depuis les années 2000, les scientifiques utilisent une alternative expérimentale qui consiste à identifier la présence de la protéine anormale du prion dans les échantillons grâce à la Protein Misfolding Cyclic Amplification (ou PMCA). A partir d'extraits de cerveaux de souris transgéniques surexprimant la protéine du prion normal, cette technique permet d'amplifier de faibles quantités de la protéine prion anormale qui deviennent alors détectables par les techniques classiques de biochimie. Or, les chercheurs Inra des unités Virologie et immunologie moléculaires et Interactions hôtes-agents pathogènes (Inra, ENVT) ont amélioré cette méthode avec des extraits de cellules en culture.
Dans un premier temps, ils ont développé un modèle cellulaire permettant l'expression des protéines prion normales d'une espèce donnée (humaine, ovine, murine, de hamster...) - voir image ci-dessous. Puis, ils ont mis au point, optimisé et adapté à grande échelle un procédé PMCA basé sur l'utilisation d'extraits protéiques de ces cellules. Cette nouvelle technique permet d'amplifier le prion de plusieurs espèces, y compris celui du variant de la Maladie de Creutzfeldt-Jakob. La sensibilité de cette méthode dite Cell-based PMCA est très proche de celle obtenue avec les extraits de cerveaux de souris. Elle est rapide (les résultats sont obtenus en 3 à 4 jours) et son développement devrait faciliter les recherches sur les maladies à prion.
Grâce à la nouvelle méthode, les chercheurs de l'Inra ont déjà démontré que les parties glycosylées des protéines de prion anormales (c'est-à-dire les sucres attachés naturellement à la protéine) n'étaient pas impliquées directement dans la transmission de ses propriétés pathologiques ; celles-ci étant associées à l'organisation intrinsèque de la particule protéique infectieuse. Par ailleurs, en termes bioéthique et pratique, ce procédé constitue une étape prometteuse vers une réduction de l'expérimentation animale. Il devrait également ouvrir la voie au développement de méthodes sensibles de diagnostic du prion humain.
Référence :
Mohammed Moudjou, Jérôme Chapuis, Mériem Mekrouti, Fabienne Reine, Laetitia Herzog, Pierre Sibille, Hubert Laude, Didier Vilette, Olivier Andréoletti, Human Rezaei, Michel Dron et Vincent Béringue. PrP glycosylation-independent amplification of prions using highly efficient, cell-based, protein misfolding cyclic amplification. Scientifc Reports, 7 juillet 2016. doi:10.1038/srep29116
Contact(s) scientifique(s):
Mohammed Moudjou - Unité Virologie et immunologie moléculaires
Vincent Béringue - Unité Virologie et immunologie moléculaires