Restez toujours informé: suivez-nous sur Google Actualités (icone ☆)
Une équipe composée de chercheurs français et anglais des laboratoires Molécules de Communication et Adaptation des Microorganismes (Muséum national d'Histoire naturelle / CNRS) et Membrane Protein Lab (Diamond Light Source / Imperial College London) présente dans Nature Chemical Biology la première structure cristalline du récepteur FhuA, normalement utilisé par les bactéries pour l'import du fer, en complexe avec un peptide de défense de bactérie, la microcine J25 (MccJ25). Cette structure montre que MccJ25 prend la place du ligand naturel du récepteur, le ferrichrome, permettant ainsi au peptide antimicrobien de traverser la membrane des bactéries cibles et de les tuer. Cette stratégie, utilisée par les bactéries comme moyen de compétition au sein des communautés microbiennes, constitue une piste précieuse pour concevoir de nouveaux antibiotiques plus efficaces.
Le fer est un élément indispensable à la croissance des bactéries mais il est difficilement mobilisable dans l'environnement du fait de sa mauvaise solubilité. Pour l'importer, les bactéries produisent des molécules nommées sidérophores (le ferrichrome chez Escherichia coli) qui complexent le fer et sont reconnues par des récepteurs à haute affinité (tel FhuA chez E. coli) assurant leur passage dans le cytoplasme. En récupérant le fer dans leur environnement, ces récepteurs apportent un avantage aux bactéries, mais constituent également une porte d'entrée pour des composés antimicrobiens produits par d'autres bactéries en compétition ou pour l'infection par des bactériophages.
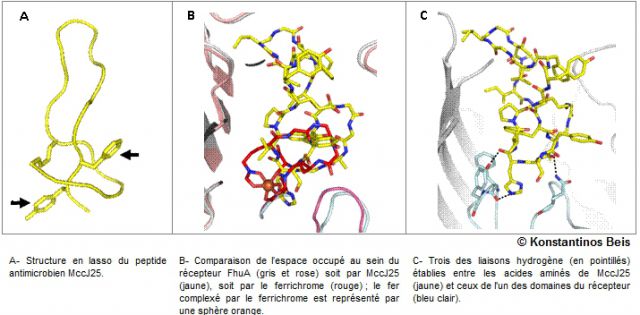
Le peptide antimicrobien MccJ25 produit par E. coli est caractérisé par une topologie peu courante, dite en lasso, formée d'un cycle traversé par une queue peptidique (fig. A), qui est solidement maintenue dans le cycle par des groupements encombrants (flèches noires). Bien que MccJ25 ne possède aucune similarité de structure avec le ferrichrome, il a la capacité de prendre sa place au sein du récepteur FhuA (fig. B), qu'il "détourne" ainsi de sa fonction initiale pour pénétrer dans les bactéries. Il les tue alors en interagissant avec une enzyme cytoplasmique, l'ARN polymérase, dont il bloque le fonctionnement.
Illustration/ CNRS/ Muséum national d'Histoire naturelle
Les chercheurs ont déterminé pour la première fois, par cristallographie aux rayons X, la structure cristalline du récepteur FhuA en complexe avec le peptide antimicrobien MccJ25. Celui-ci occupe complètement le canal du récepteur et le bouche car la liaison avec MccJ25 implique les différentes régions du récepteur (fig. C). De plus, la connaissance de cette structure cristalline, en lien avec des expériences de compétition entre MccJ25 et le phage T5 et des études de liaison de ligands par spectrométrie de masse en conditions non dénaturantes, a permis d'identifier les acides aminés engagés dans l'interaction.
Ce travail apporte ainsi, pour la première fois, les preuves structurales du mécanisme de reconnaissance entre le récepteur FhuA et le peptide antimicrobien MccJ25. Il permet de mieux comprendre comment les peptides de défense de type lasso, produits par les bactéries dans les communautés bactériennes, ont acquis des spectres d'activité étroits ; ce qui ouvre de nouvelles perspectives dans le domaine pharmaceutique, vers la conception d'antibiotiques mieux ciblés et plus actifs.