Restez toujours informé: suivez-nous sur Google Actualités (icone ☆)

Le rôle du récepteur Fas (CD95/TNFRSF6) et de son ligand FasL (CD96L/TNFSF6) dans le contexte tumoral, bien que souvent étudié, restait encore très mal compris en raison de sa capacité de pouvoir inhiber la progression tumorale mais aussi, dans certaines circonstances, la promouvoir. En effet Le récepteur Fas, largement connu comme activateur d'une mort cellulaire par apoptose, peut aussi exercer un rôle dans la survie de la cellule conduisant à sa prolifération ou sa migration. Ces connaissances ont conduit à deux types de stratégies anti cancéreuses, l'une exploitant la fonction pro-apoptotique de Fas (APO010), l'autre inhibant sa fonction pro-survie (APG101). Cependant, aucun résultat ne permettait jusqu'à présent de comprendre comment un rôle de Fas est favorisé par rapport à l'autre, ce qui constituait un défi majeur dans les thérapies "Fas basées".
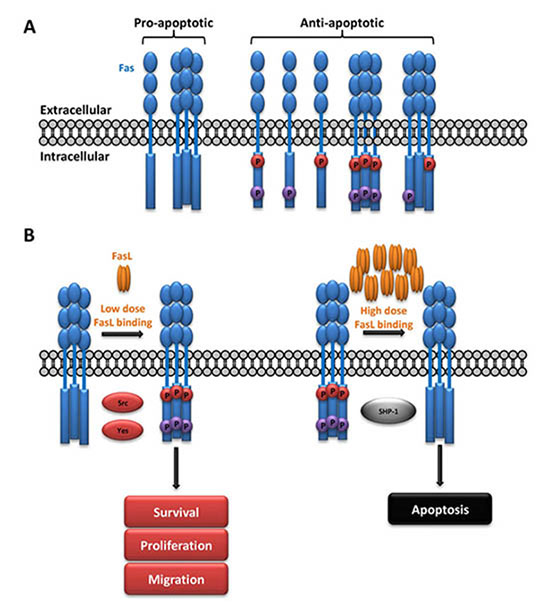
Figure: (A). Le niveau de phosphorylation du domaine cytoplasmique du récepteur Fas est corrélé à sa capacité fonctionnelle. (B). Modèle du mécanisme moléculaire pouvant rendre compte du rôle de la phosphorylation de Fas dans la versatilité des signaux.
© Anne-Odile Hueber
L'équipe d'Anne-Odile Hueber identifie le rôle critique d'une modification post traductionnelle de ce récepteur, la phosphorylation. Les chercheurs démontrent que le signal de mort ne peut être transmis à la suite de l'engagement du ligand sur son récepteur que si les deux résidus tyrosine du domaine de mort du récepteur Fas sont déphosphorylés. La phosphorylation d'un des deux résidus, ou des deux, non seulement bloque totalement le signal de mort mais initie un signal de survie qui, selon le contexte, peut engendrer la prolifération ou la migration de la cellule. Par ailleurs, en comparant le niveau relatif de phosphorylation des deux résidus tyrosine dans des tissus cancéreux et sains, ils mettent en évidence que les patients atteints d'un cancer du côlon, du sein ou de l'ovaire, présentent un niveau plus élevé des deux résidus phosphorylés. Ceci n'est pas le cas chez des patients atteints d'un cancer du poumon ou du col de l'utérus.
Ces profils de phosphorylation distincts selon l'origine primaire du cancer, suggèrent que le mode de signalisation du récepteur pourrait être dépendant du type de cancer: alors que des signaux de survie engendrés par Fas pourraient être prédominants dans certains tissus cancéreux (côlon, sein, ovaire), ils pourraient s'avérer plus anecdotiques dans d'autres (poumon, col de l'utérus).
Cette découverte pourra être utilisée en clinique en proposant la phosphorylation de Fas comme un biomarqueur prédictif dans les cellules cancéreuses, ce qui pourrait permettre de faire un choix dans les thérapies "Fas basées" (agoniste de mort vs antagoniste de survie) et donc d'espérer augmenter le succès thérapeutique.
Pour plus d'information voir:
An Evolution-Guided Analysis Reveals a Multi-Signaling Regulation of Fas by Tyrosine Phosphorylation and its Implication in Human Cancers.
Chakrabandhu K, Huault S, Durivault J, Lang K, Ta Ngoc L, Bole A, Doma E, Dérijard B, Gérard JP, Pierres M, Hueber AO.
PLoS Biol. 2016 Mar 4;14(3):e1002401. doi: 10.1371/journal.pbio.1002401.