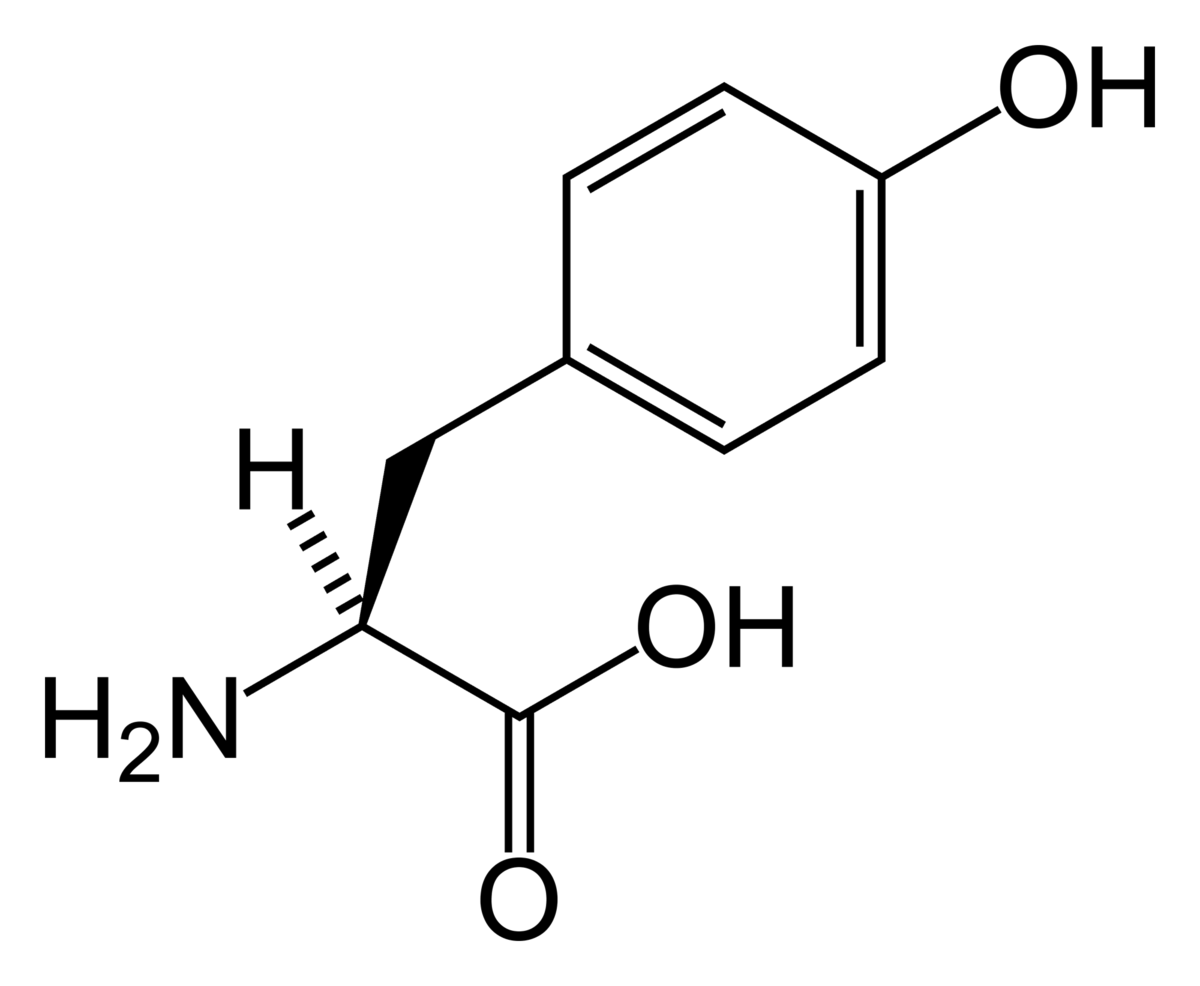
Tyrosine - Définition
La liste des auteurs de cet article est disponible ici.
Introduction
| Tyrosine | |
|---|---|
| |
| Général | |
| Nom IUPAC | |
| Synonymes | Y, Tyr |
| No CAS | (racémique) (L) ou S(–) (D) ou R |
| No EINECS | |
| DrugBank | |
| PubChem | |
| ChEBI | |
| FEMA | |
| SMILES | |
| InChI | |
| Propriétés chimiques | |
| Formule brute | C9H11NO3 |
| Masse molaire | 181,1885 ± 0,0091 g·mol-1 |
| pKa | 2,2 |
| Propriétés physiques | |
| T° fusion | 343 °C (décomposition) |
| Solubilité | 479 mg·l-1 (eau,25 °C) |
| Thermochimie | |
| S0 | 214,01 J·mol-1·K-1 |
| ΔH0 | -685,6 kJ·mol-1 |
| Cp | 216,44 J·mol-1·K-1 (solide,25 °C) |
| Propriétés biochimiques | |
| Codons | UAU, UAC |
| Précautions | |
| | |
| Produit non contrôlé | |
| | |
La tyrosine (Tyr ou Y) est un acide aminé aromatique, polaire. Henri Laborit fut un des premiers chercheurs à l'employer et à obtenir les brevets mondiaux d'application thérapeutique, dans le traitement des états de choc, des dépressions, de l'hypertension artèrielle et de la maladie de Parkinson. Il dut abandonner car il ne trouva personne à l'époque pour les exploiter.
Elle participe à la synthèse des catécholamines : l'adrénaline, la noradrénaline, la dopamine et la DOPA. Elle est aussi précurseur de la mélanine (pigment qui colore la peau, les poils, l'iris)et des hormone thyroïdienne (formation de thyronine à partir de deux tyrosine).
Elle peut être synthétisée, dans le corps, à partir de la phénylalanine, sauf en cas de phénylcétonurie (maladie résultant d'une accumulation de phénylalanine dans le sang due à l'absence d'une protéine fonctionnelle: la phénylalanine hydroxylase). Elle est donc non indispensable, sauf en l'absence de phénylalanine.
Le noyau aromatique de la tyrosine (ou parahydroxy phénylalanine) comprend un groupement hydroxyl qui rend sa chaine latérale moins hydrophobe que celle de la phénylalanine (mais la tyrosine est un acide aminé nettement moins soluble dans l'eau que la phénylalanine). Cette fonction hydroxyle lui permet d'être phosphorylée par des enzymes appelés kinases. La phosphorylation d'un acide aminé a très souvent un rôle de régulation de l'activité de l'enzyme elle même. La thréonine et la sérine sont deux autres acides aminés pouvant subir la même phosphorylation.
La tyrosine peut également être modifiée en (3-)nitrotyrosine. Cette réaction de nitration peut affecter la tyrosine en tant qu'acide aminé libre ou que résidu d'acide aminé intégré dans une chaîne polypeptidique. In vivo, cette réaction est majoritairement due à l'action de l'acide péroxynitreux (ou péroxynitrite, ONOOH), mais d'autres voies réactionnelles peuvent également aboutir à la formation de nitrotyrosine. In vitro, le tétranitrométhane (TNM) a aussi été utilisé dans ce but. La nitration de tyrosines est généralement vue comme un phénomène pathologique (e.g. l'augmentation de la concentration plasmatique de nitrotyrosine est considérée comme un biomarqueur de phénomènes inflammatoires), bien que la possibilité que cette réaction soit également un phénomène physiologique ait récemment été suggérée.