Restez toujours informé: suivez-nous sur Google Actualités (icone ☆)
© Vincent Pagès
L'ADN de tout organisme vivant est constamment endommagé par de nombreux agents (composés chimiques, rayonnement ultra-violet, etc...). Ces dommages perturbent le processus de réplication (qui consiste à dupliquer la molécule d'ADN avant que la cellule ne se divise) et vont générer une brèche d'ADN simple-brin qui doit être réparée. Deux processus permettent de combler cette brèche:
- la synthèse translésionnelle: elle fait appel à des enzymes spécialisées qui vont remplir cette brèche malgré la lésion présente, mais avec le risque de générer des erreurs ou mutations.
- La voie du contournement des dommages qui consiste à chercher une région homologue sur l'autre brin d'ADN qui vient d'être répliqué. En recopiant la séquence provenant du brin non-endommagé, cela permet à la cellule de combler la brèche sans risque d'erreur.
Les scientifiques ont étudié les différentes phases de la voie du contournement des dommages, également appelée "recombinaison homologue" et montré que la première étape de la recombinaison homologue (appelée phase présynaptique) est une élément clé dans la mutagenèse. En effet, les résultats indiquent qu'un défaut dans l'élargissement des brèches d'ADN simple-brin, ou qu'un défaut dans le chargement de la recombinase RecA vont diminuer la recombinaison homologue et favoriser la synthèse translésionnelle qui est la voie mutagène.
De manière très intéressante, les scientifiques montrent aussi qu'en inhibant la recombinaison homologue à un stade plus tardif (phase post-synaptique), il n'y a pas d'augmentation de l'utilisation de la voie mutagène.
Ces résultats, s'ils sont confirmés dans les cellules humaines, pourraient ouvrir la voie à de nouvelles stratégies dans le traitement des cancers: cibler spécifiquement la phase post-synaptique de la recombinaison homologue pourrait permettre de sensibiliser les cellules aux chimiothérapies sans permettre à la synthèse translésionnelle de contribuer à la survie des cellules, ni d'augmenter la mutagenèse.
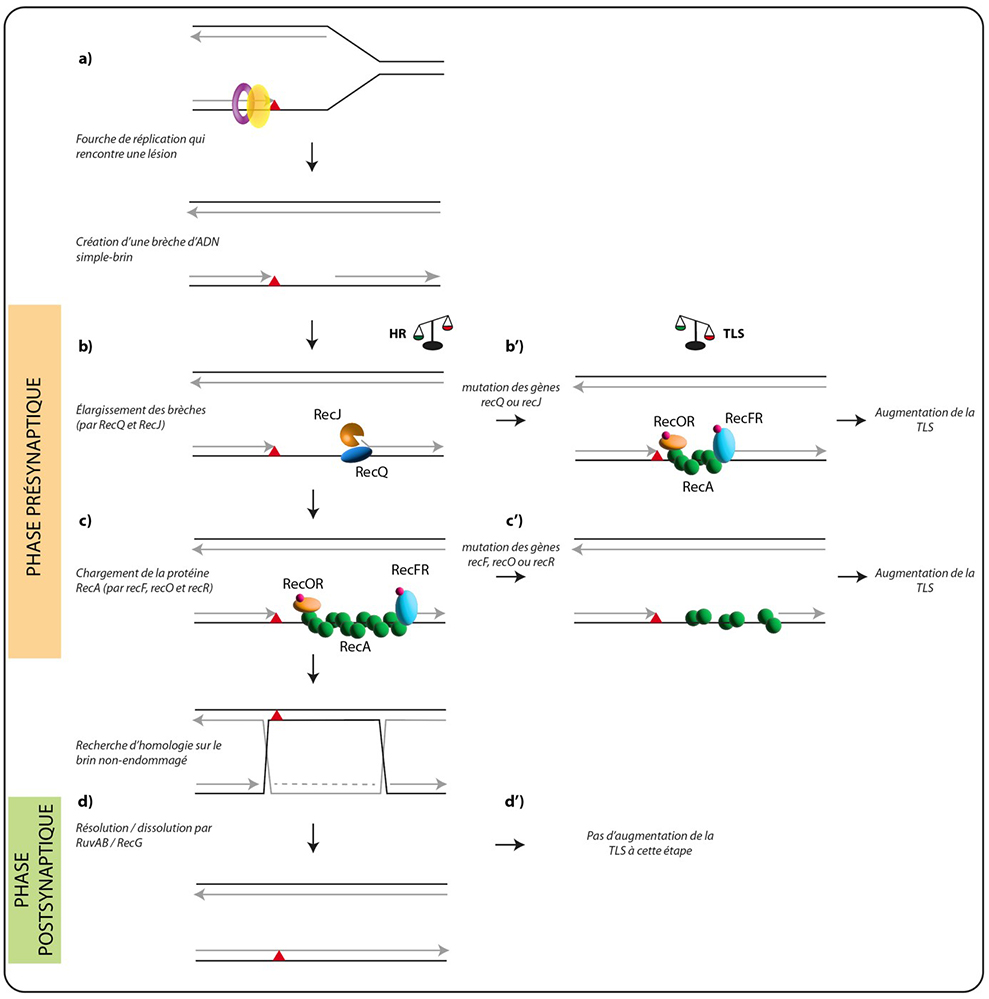
a) lorsque le fourche de réplication rencontre une lésion (triangle rouge), une brèche d'ADN simple-brin est générée en aval de la lésion.
b) Cette brèche est élargie par les protéines RecQ et RecJ afin de faciliter la recherche d'homologie.
c) Les protéines RecFR et RecOR facilitent le chargement de la recombinase RecA sur cette brèche. C'est RecA qui permet la recherche d'homologie et de contourner la lésion de manière fidèle.
d) Une fois l'homologie trouvée, il faut résoudre la jonction entre les quatre brins d'ADN. Cette étape est réalisée par RuvAB et RecG.
b') En l'absence de recQ ou recJ, la recombinaison homologue (HR) est moins efficace et la synthèse translésionnelle (TLS) est favorisée.
c') De même en l'absence de recFOR, le chargement de RecA est moins efficace et la TLS est favorisée.
d') En l'absence de RuvAB/RecG, la recombinaison homologue est également moins efficace, mais la TLS n'augmente pas à cette étape.
© Vincent Pagès, Luisa Laureti.
Pour en savoir plus:
Single strand gap repair: The presynaptic phase plays a pivotal role in modulating lesion tolerance pathways.
Luisa Laureti, Lara Lee, Gaëlle Philippin, Michel Kahi, Vincent Pagès.
PLoS Genetics 2 juin 2022. https://doi.org/10.1371/journal.pgen.1010238
Laboratoire:
Centre de recherche en cancérologie de Marseille (CRCM) (CNRS/Inserm/Aix Marseille Université/Institut Paoli Calmettes)
27 bd Leï Roure. 13273 Marseille Cedex 09.
Contact:
Vincent Pagès - Chercheur CNRS au Centre de recherche en cancérologie de Marseille (CRCM) (CNRS/Inserm U1068/Aix Marseille Université) - vincent.pages at cnrs.fr