Restez toujours informé: suivez-nous sur Google Actualités (icone ☆)
De nombreux traitements anticancéreux éliminent les cellules tumorales en cassant leur ADN. Certaines cellules survivent à ces cassures en les réparant, ce qui limite l'efficacité de ces traitements. Des chercheurs de l'Institut de pharmacologie et de biologie structurale ont découvert le fonctionnement d'une des premières étapes clefs de cette réparation. Leurs résultats, qui ont révélé de nouvelles cibles thérapeutiques potentielles pour le traitement des cancers, sont publiés dans la revue Nature Communications.
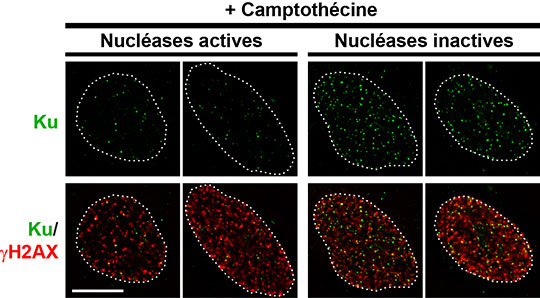
Figure: Visualisation de la protéine Ku (en vert) sur des cassures de l'ADN (en rouge) dans les noyaux de cellules humaines traitées par la camptothécine. Ku est normalement éliminée de l'extrémité des cassures induites par la camptothécine grâce à l'activité de plusieurs nucléases (panneaux de gauche). Lorsque ces nucléases sont inactives (panneaux de droite), Ku s'accumule sur les cassures induites par la camptothécine, ce qui bloque leur réparation et conduit à la mort cellulaire.
©Sébastien Britton. IPBS.
La Jonction d'Extrémités Non Homologue (JENH) est une voie très efficace de réparation des cassures de l'ADN ; elle consiste à recoller ensemble les deux extrémités de la cassure. Pour ce faire, une protéine très abondante, en forme d'anneau, la protéine Ku (prononcer Kou !), détecte et recouvre très rapidement chacune des extrémités de la cassure, puis sert de point d'attache pour les autres protéines de cette voie de réparation.
Parmi les traitements anticancéreux, la camptothécine et ses dérivés, conduisent à des cassures de l'ADN particulières qui n'ont qu'une seule extrémité. En absence d'une seconde extrémité, le recollage par JENH n'est pas possible et les cassures d'ADN générées par la camptothécine doivent donc être réparées par une autre voie, la Recombinaison Homologue. Les chercheurs de l'équipe de Patrick Calsou à l'Institut de Pharmacologie et de Biologie Structurale montrent que les cassures à une seule extrémité, induites par la camptothécine, bien que non réparées par JENH, sont tout de même reconnues initialement par la protéine Ku. Ces travaux ont également établi que d'autres protéines qui coupent l'ADN, des nucléases, enlèvent par la suite la protéine Ku de ces cassures. Ces protéines fonctionnent de façon coordonnée en découpant l'extrémité d'ADN portant Ku, tout en modifiant cette extrémité pour empêcher Ku de s'y refixer. Ce mécanisme est contrôlé par la protéine kinase ATM qui active une de ces nucléases par phosphorylation. Enfin, ces travaux montrent que lorsque ce mécanisme est inhibé, la persistance de Ku bloque l'assemblage des protéines de réparation par Recombinaison Homologue ce qui, en absence de réparation adéquate des cassures, conduit à la mort cellulaire.
Ces travaux de caractérisation des processus fondamentaux de réparation des cassures de l'ADN conduisent à la mise en évidence de mécanismes complexes et essentiels à la survie cellulaire en présence de certains agents anticancéreux. Ils ont également livré plusieurs cibles thérapeutiques potentielles, comme la kinase ATM, pour lesquelles l'équipe de Patrick Calsou recherche actuellement de nouveaux inhibiteurs dont l'utilisation thérapeutique pourra être testée.
Ces travaux ont été réalisés en collaboration avec l'équipe de Steve Jackson du Wellcome Trust and Cancer Research UK au Gurdon Institute à Cambridge (G-B).
Publication:
Coordinated nuclease activities counteract Ku at single-ended DNA double-strand breaks. Pauline Chanut, Sébastien Britton, Julia Coates, Stephen P. Jackson and Patrick Calsou.
Nature Communications. 7, Article number:12889. doi:10.1038/ncomms12889
Contact chercheur:
Patrick Calsou
Institut de Pharmacologie et de Biologie Structurale
CNRS UMR 5089, Université Paul Sabatier
Equipe Labellisée Ligue Nationale Contre le Cancer
205 route de Narbonne
31077 Toulouse
Sébastien Britton
Institut de Pharmacologie et de Biologie Structurale
CNRS UMR 5089, Université Paul Sabatier
Equipe Labellisée Ligue Nationale Contre le Cancer
205 route de Narbonne
31077 Toulouse