Zu diesen Krankheiten gehört die berüchtigte Schlafkrankheit, die durch einen Parasiten namens Trypanosoma brucei verursacht wird. Dieser Parasit wird durch den Stich der Tsetsefliege auf Menschen und Tiere übertragen. Beim Menschen verursacht er schwere neurologische Störungen und bei Tieren die Nagana, eine Krankheit, die das Vieh stark beeinträchtigt.
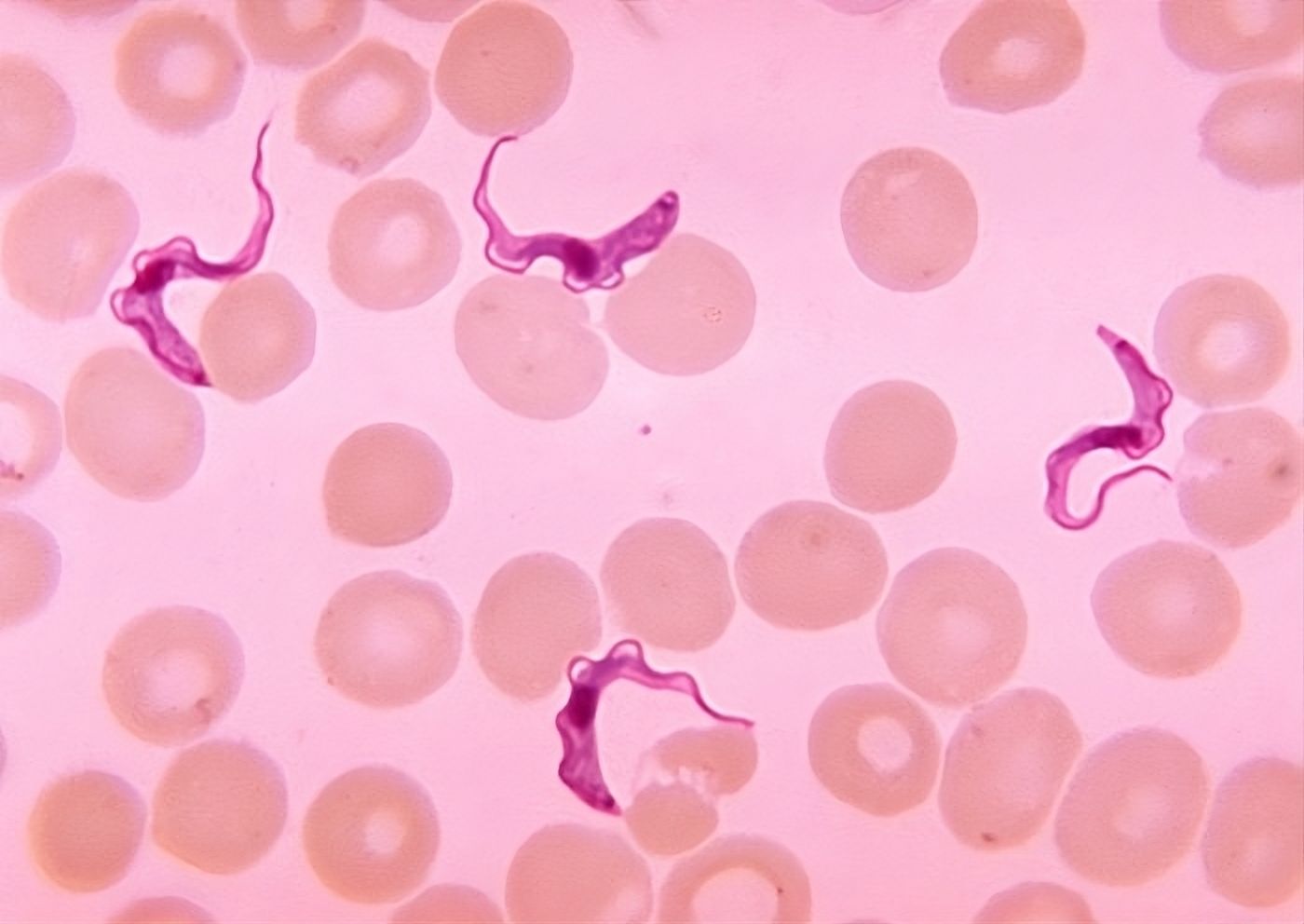
Trypanosoma brucei im Blut eines Patienten mit afrikanischer menschlicher Trypanosomiasis, allgemein bekannt als Schlafkrankheit.
Bild Wikimedia
Das Bild verdüstert sich weiter, wenn man bedenkt, dass die derzeitigen Behandlungen selten, toxisch und aufgrund der zunehmenden Resistenz immer weniger wirksam sind.
Bei diesem Parasit verändert eine einzigartige Mitochondrie ihre Form und Funktion
Im Gegensatz zu den meisten lebenden Zellen, die mehrere Mitochondrien (die "Kraftwerke" der Zelle) besitzen, hat Trypanosoma brucei nur eine einzige, die je nach Umgebung ihre Form und Funktion völlig verändert, was Mechanismen der Membranfusion und -teilung beinhaltet.
In der Tsetsefliege erscheint die Mitochondrie des Parasiten in einer netzartigen Form, groß und sehr aktiv, die Energie durch einen komplexen Prozess namens oxidative Phosphorylierung produziert. Aber sobald sie im Blut des Säugetiers ist, reduziert sich die Mitochondrie des Parasiten erheblich zu einem einfachen Schlauch, und der Parasit nutzt hauptsächlich Zucker (Glukose) zur Energiegewinnung durch einen viel einfacheren Prozess: die Glykolyse.
Bei den meisten Lebewesen sind Mitochondrien sehr dynamisch: Sie fusionieren oder teilen sich ständig, um sich den Bedürfnissen der Zelle anzupassen. Diese Prozesse, die bei Säugetierzellen oder der Bäckerhefe Saccharomyces cerevisiae gut beschrieben sind, werden durch Proteine der Dynamin-Familie reguliert. Diese Proteine besitzen eine GTP-hydrolysierende Domäne und Strukturen, die es ihnen ermöglichen, sich an Membranen zu binden und zu oligomerisieren.
Bei Trypanosoma brucei bildet die Mitochondrie ein einzigartiges und kontinuierliches Netzwerk, das sich nur teilt, wenn die Zelle selbst sich teilt. Bis vor kurzem waren bei diesem Parasiten nur Proteine identifiziert worden, die an der Teilung der Mitochondrien beteiligt sind. Die für die Fusion verantwortlichen Proteine, die bei Menschen oder Hefen (wie Mfn oder Opa1) vorhanden sind, schienen einfach nicht vorhanden zu sein, was auf einen anderen Fusionsmechanismus hindeutet.
Ein neues Protein der Dynamin-Familie könnte der Grund für diese Besonderheit sein
In einem Artikel, der in der Zeitschrift Current Biology veröffentlicht wurde, entdeckten Wissenschaftler bei Trypanosoma brucei ein neues Protein der Dynamin-Familie, genannt TbMfnL (Trypanosoma brucei Mitofusin-Like). Dieses Protein scheint von einer alten Protein-Familie abzustammen, die bei vielen Lebewesen (einschließlich einiger Bakterien) vorhanden ist, aber bei Säugetieren und Hefen fehlt. Es könnte daher ein uraltes Überbleibsel eines Mechanismus zur Umgestaltung von Zellmembranen sein.
Ihre Ergebnisse zeigen, dass TbMfnL in der inneren Mitochondrienmembran verankert ist, auf der Matrixseite (das Innere der Mitochondrie), was für Proteine, die Mitochondrienmembranen umgestalten, neu ist. Durch die Erhöhung der Produktion von TbMfnL in der Zelle beobachteten die Wissenschaftler eine starke Zunahme der Vernetzung und Verzweigung der mitochondrialen Filamente, ein Mechanismus, der von der GTP-Hydrolyse abhängt, die die notwendige Energie liefert. Mit anderen Worten, TbMfnL könnte in der Lage sein, die Form der Mitochondrie von innen heraus zu modulieren, durch einen völlig anderen Mechanismus als bei anderen Eukaryoten.
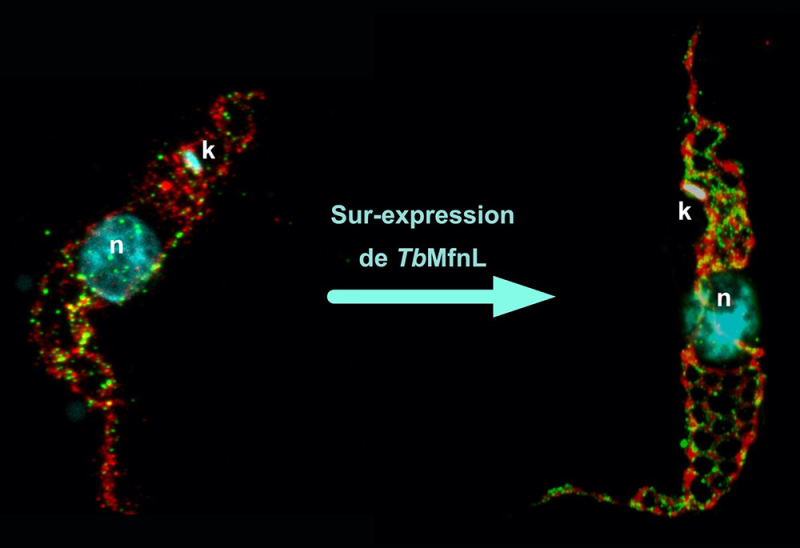
Markierung der Mitochondrie eines Wildtyp-Trypanosoms und eines Trypanosoms, das das Protein TbMfnL überexprimiert, durch Expansionsmikroskopie. Rot, Markierung der mitochondrialen Matrix (Threonin-Dehydrogenase, Tdh); Grün, Membranmarkierung des Proteins TbMfnL; Cyan, Markierung des Zellkerns (n) und der mitochondrialen DNA (k, Kinetoplast).
© Emmanuel Tetaud
Diese Entdeckung ebnet den Weg für ein neues Verständnis der Mechanismen der mitochondrialen Membranstruktur und allgemein der Zellmembranen, nicht nur bei Trypanosoma brucei, sondern auch bei anderen Organismen. Langfristig könnte diese Entdeckung es ermöglichen, den Parasiten effektiver anzugreifen, indem man ein wesentliches und einzigartiges Element ins Visier nimmt. Und warum nicht spezifischere, weniger toxische Behandlungen entwickeln, die menschliche Zellen verschonen.