🩺 Wirksame Diabetes-Medikamente im Kampf gegen Krebs
Ein Zusammenhang zwischen Typ-2-Diabetes und einem höheren Risiko für bestimmte Krebsarten, wie etwa Leber- oder Darmkrebs, ist bereits anerkannt. Doch die üblichen Erklärungen, wie überschüssiger Zucker im Blut oder Übergewicht, scheinen nicht auszureichen. Diese Beobachtung lenkte die Forschung daher auf einen originellen Ansatz: Könnten die gegen Diabetes verschriebenen Moleküle eine direkte Rolle in der Biologie von Tumoren spielen?
Eine am 10. Dezember 2025 in der Zeitschrift Clinical Precision Medicine veröffentlichte Analyse untersucht diese Hypothese. Diese Arbeit überprüft mehrere Klassen von Medikamenten, darunter Metformin, SGLT2-Hemmer und GLP-1-Rezeptoragonisten. Sie zeigt, dass diese Behandlungen grundlegende Prozesse für Krebserkrankungen verändern können. Ihre Wirkungen könnten somit die Geschwindigkeit der Zellvermehrung, die Regulation von Entzündungen oder auch die Reaktion des Immunsystems betreffen.
Nehmen wir das Beispiel Metformin, ein sehr verbreitetes Medikament. Dieses scheint mit mehreren für das Tumorwachstum wichtigen Signalwegen zu interagieren. Andere Moleküle, wie die SGLT2-Hemmer, zeigen ebenfalls ein Potenzial, die Zellproliferation zu verlangsamen oder Entzündungen abzuschwächen. Es ist jedoch festzuhalten, dass diese Effekte nicht systematisch auftreten. Sie hängen tatsächlich von der Art des betreffenden Krebses oder dem genau verwendeten Molekül ab.
Diese Heterogenität unterstreicht die Notwendigkeit, die Untersuchungen fortzusetzen. Wie Dr. Linong Ji, Mitautor der Analyse, andeutet, sind diese Medikamente zwar unverzichtbar für die Behandlung von Diabetes, doch ihre weiter gefassten Auswirkungen auf Krebs sind noch nicht vollständig aufgeklärt. Die verfügbaren Daten zeigen sich teilweise widersprüchlich und müssen durch ergänzende Arbeiten gestützt werden.
Ein genaues Verständnis dieser Mechanismen könnte vielversprechende Perspektiven eröffnen. Langfristig könnte es ermöglichen, die therapeutischen Strategien für Patienten, die sowohl mit Diabetes als auch mit Krebs konfrontiert sind, zu verfeinern. Es könnte auch präventive Ansätze fördern, insbesondere für Bevölkerungsgruppen mit einem hohen Risiko für diese beiden Erkrankungen.
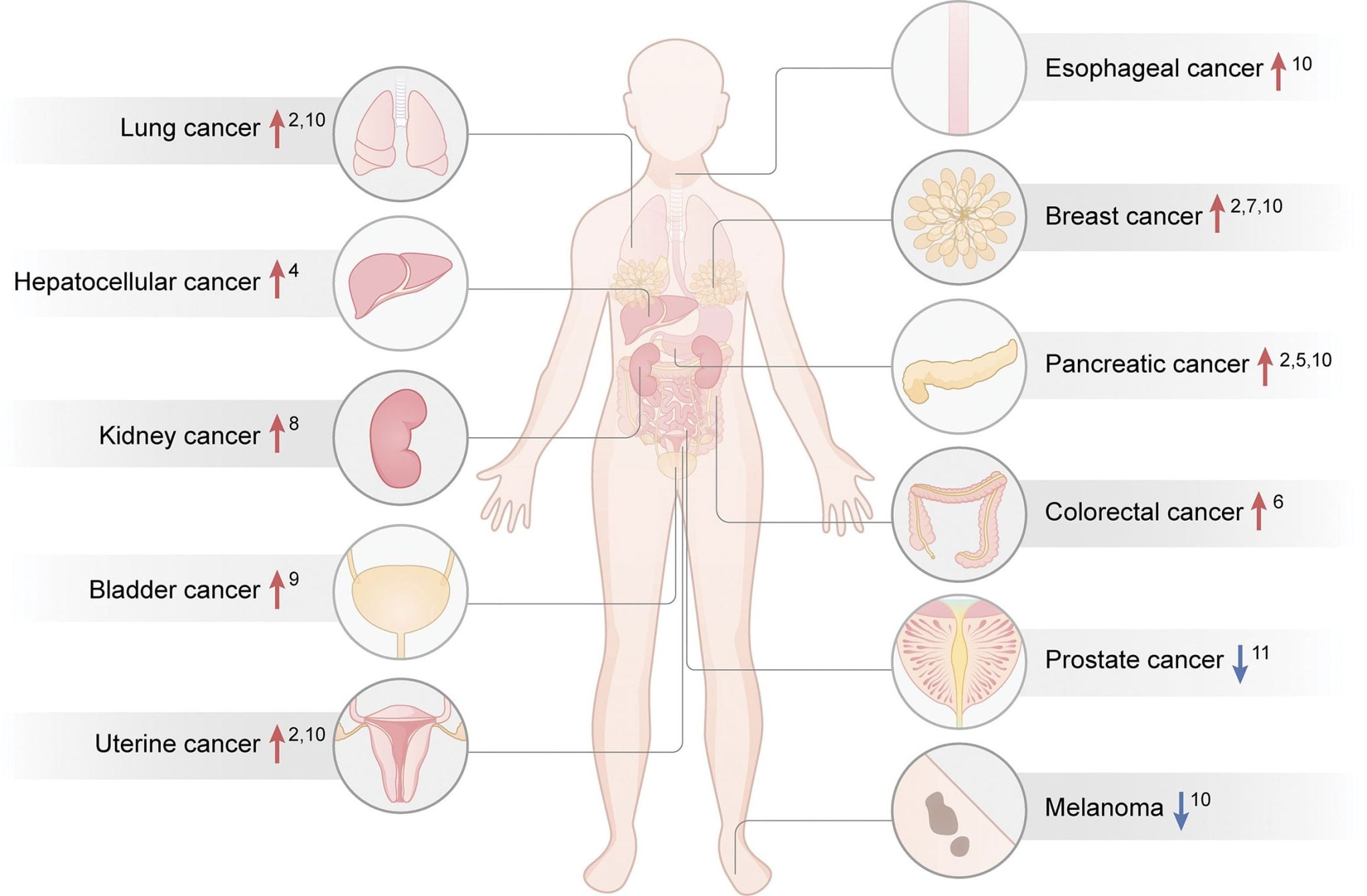
Infografik, die den Zusammenhang zwischen Typ-2-Diabetes und einem erhöhten (Pfeil nach oben) oder verringerten (Pfeil nach unten) Risiko für bestimmte spezifische Krebsarten veranschaulicht.
Quelle: Precision Clinical Medicine
Die laufenden Forschungen ebnen so den Weg für künftige klinische Studien. Ihr Ziel wird es sein, zu bewerten, ob bestimmte vorhandene Medikamente optimiert oder als Ergänzung zu konventionellen Krebstherapien eingesetzt werden könnten.
Wie kann ein Medikament auf mehrere Krankheiten wirken?
Medikamente werden oft entwickelt, um einen präzisen biologischen Weg zu treffen, der mit einer Krankheit verbunden ist. Der Organismus funktioniert jedoch wie ein vernetztes System. Ein Molekül, das auf einen bestimmten Rezeptor oder ein bestimmtes Enzym wirkt, kann daher Auswirkungen auf andere Prozesse haben, manchmal weit entfernt von seiner Hauptwirkung. Das nennt man pleiotrope Effekte.
Diese vielfältigen Effekte können erklären, warum eine Behandlung gegen Diabetes, wie Metformin, auch Krebs beeinflussen könnte. Indem es den Zellstoffwechsel oder die Umgebung, in der ein Tumor wächst, verändert, schafft das Medikament Bedingungen, die für sein Wachstum weniger günstig sind. Es greift die Krebszellen nicht direkt an, sondern verändert das Milieu.
Dieser Ansatz eröffnet Möglichkeiten für die Wiederverwendung bestehender Medikamente. Anstatt ein neues Molekül von Grund auf zu entwickeln, erforschen Wissenschaftler, ob eine bereits zugelassene und für eine Indikation gut bekannte Behandlung auch für eine andere nützlich sein könnte. Dies kann die Forschung beschleunigen und schneller neue therapeutische Optionen bieten.
Dennoch erfordert diese Strategie eine rigorose Validierung. Die im Labor oder in bestimmten Studien beobachteten Effekte müssen durch speziell konzipierte klinische Studien bestätigt werden, um die Wirksamkeit und Sicherheit im neuen Kontext der Zielkrankheit zu bewerten.