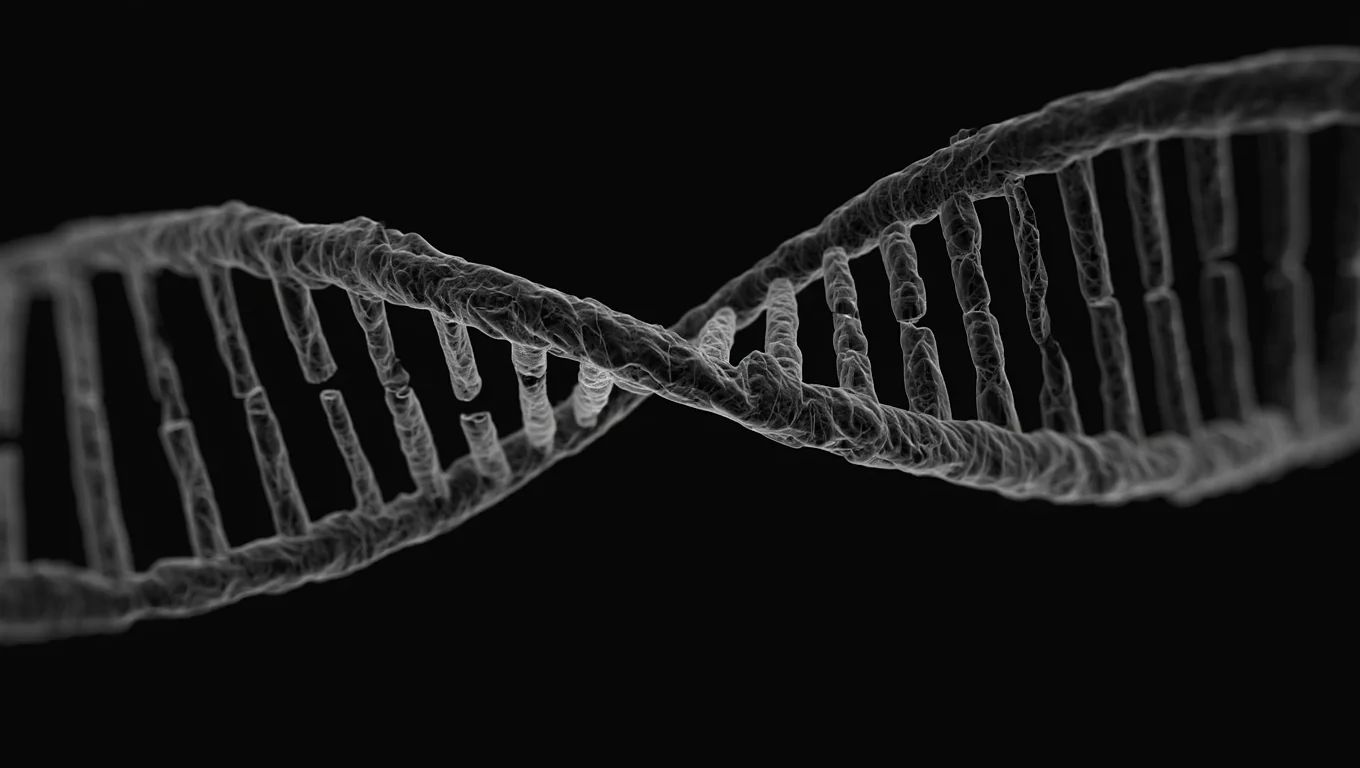
Das internationale Team nutzte die Kryo-Elektronenmikroskopie, um eine Helikase zu beobachten, ein Enzym, das für die DNA-Replikation essenziell ist. Diese Arbeit enthüllt einen weitaus subtileren Mechanismus als bisher angenommen, mit potenziellen Auswirkungen auf die Behandlung von Virusinfektionen und Krebs.
Die einzigartige Funktionsweise der Helikase
Im Gegensatz zu früheren Annahmen trennt die Helikase die DNA-Stränge nicht sofort. Sie wirkt vielmehr wie ein molekularer Sechszylindermotor, der ATP verbraucht, um die Spannung zwischen den Strängen schrittweise zu lösen.
Dieser Mechanismus ermöglicht eine natürliche Entfaltung der DNA, vergleichbar mit der Entspannung einer zusammengedrückten Feder. Die Forscher entdeckten auch, dass zwei Helikasen zusammenwirken, um "Replikationsgabeln" zu bilden, die eine gleichzeitige Kopie beider Stränge gewährleisten.
Die Studie zeigt, dass dieser Prozess universell ist, von Viren bis hin zum Menschen. Diese evolutionäre Erhaltung legt nahe, dass die gezielte Blockade der viralen Helikase eine vielversprechende antivirale Strategie sein könnte, insbesondere gegen krebserregende Papillomaviren.
Medizinische und technologische Anwendungen
Die Helikasen von Viren wie Pocken oder bestimmten Krebsarten nutzen denselben Mechanismus wie die menschlichen Zellen. Durch gezielte Beeinflussung ihrer Funktionsweise könnten Behandlungen entwickelt werden, die ihre Replikation blockieren, ohne die gesunde DNA zu beeinträchtigen.
Jenseits der Medizin inspiriert diese Entdeckung die Entwicklung synthetischer Nanomaschinen. Ihre Energieeffizienz, die auf ähnlichen Prinzipien beruht, könnte die Technologie auf molekularer Ebene revolutionieren.
Dank der Kryo-Elektronenmikroskopie markiert diese Studie einen Meilenstein in der Strukturbiologie. Sie zeigt, wie moderne Werkzeuge nun zelluläre Prozesse mit unübertroffener Präzision sichtbar machen können.
Weiterführend: Wie versorgt ATP molekulare Maschinen mit Energie?
Adenosintriphosphat (ATP) fungiert als universelle "Energiewährung" der Zellen. Seine chemische Struktur enthält energiereiche Phosphatbindungen, die bei ihrer Spaltung etwa 7,3 kcal/mol freisetzen. Diese Energie wird von Motorproteinen wie Helikasen genutzt, um mechanische Arbeit auf Nanoebene zu verrichten.
Wenn ATP an die Helikase bindet, induziert es eine Konformationsänderung des Enzyms. Diese Bewegung wird durch die Hydrolyse von ATP zu ADP (Adenosindiphosphat) verstärkt, wobei ein anorganisches Phosphat freigesetzt wird. Jeder Zyklus aus Bindung, Hydrolyse und Ablösung von ATP bewegt die Helikase einen "Schritt" entlang der DNA, wie ein molekularer Kolben.
Dieser Mechanismus ist bemerkenswert effizient: Ein einziges ATP-Molekül kann 1 bis 2 DNA-Basenpaare trennen. Die sechs Untereinheiten der Helikase wirken koordiniert und erzeugen eine rotierende Bewegung, die an einen Verbrennungsmotor erinnert – jedoch mit atomarer Präzision.
Studien der Biophysik zeigen, dass dieses System etwa 50 % der chemischen Energie in mechanische Arbeit umwandelt – eine Effizienz, die weit über der makroskopischer Motoren liegt. Diese Leistung erklärt, warum dieser Mechanismus von Bakterien bis zum Menschen evolutionär erhalten geblieben ist.