El glioblastoma es el cáncer más común y más mortal del sistema nervioso central en adultos. A pesar de un protocolo estándar de tratamiento establecido en 2005, que combina una cirugía máxima seguida de sesiones de radio- y quimioterapias, los pacientes sobreviven en promedio solo 15 meses después de su diagnóstico. Esta agresividad está particularmente relacionada con la presencia de células madre cancerosas llamadas células de tipo madre del glioblastoma, o GSCs. Estas células, involucradas en la iniciación, crecimiento, y recaída del tumor, son por lo tanto objetivos preferenciales para el desarrollo de nuevas estrategias terapéuticas.
Los lisosomas juegan un papel crítico en el mantenimiento de las células madre cancerosas
Los lisosomas, elementos constitutivos de la célula, forman una red dinámica de vesículas (tipo de pequeños sacos), con pH ácido, implicadas en el movimiento de sustancias dentro de la célula. Participan en los procesos metabólicos, y son responsables de la digestión de partículas ingeridas por la célula y de la degradación de componentes celulares defectuosos.
Trabajos anteriores muestran que también permiten la supervivencia de las células madre del glioblastoma fuera de su nicho protector dentro del tumor. En efecto, los lisosomas prolongan las señales de los factores de crecimiento y facilitan la difusión y proliferación de las células cancerosas. En las células madre del glioblastoma, alterar la cantidad y calidad de los lisosomas lleva a una muerte específica de estas células. Los lisosomas son así un objetivo terapéutico crítico para influir en las decisiones de vida y muerte de estas células madre del glioblastoma y así controlar su población.
Para desestabilizar la pared de los pequeños sacos que son los lisosomas, en el corazón de las células madre del glioblastoma, los científicos han identificado el papel de la proteasa MALT1 (de la familia de las paracaspasas). Inhibir esta enzima, recientemente definida como un mediador crucial en la homeostasis de los lisosomas, resulta en una muerte dependiente de lisosomas de las células madre del glioblastoma. Esto, mediante un mecanismo que implica la proteína de unión a ARNm Quaking y la modulación de la expresión de las proteínas claves del compartimento lisosomal. Sin embargo, los mecanismos de acción de MALT1 aún no están bien caracterizados.
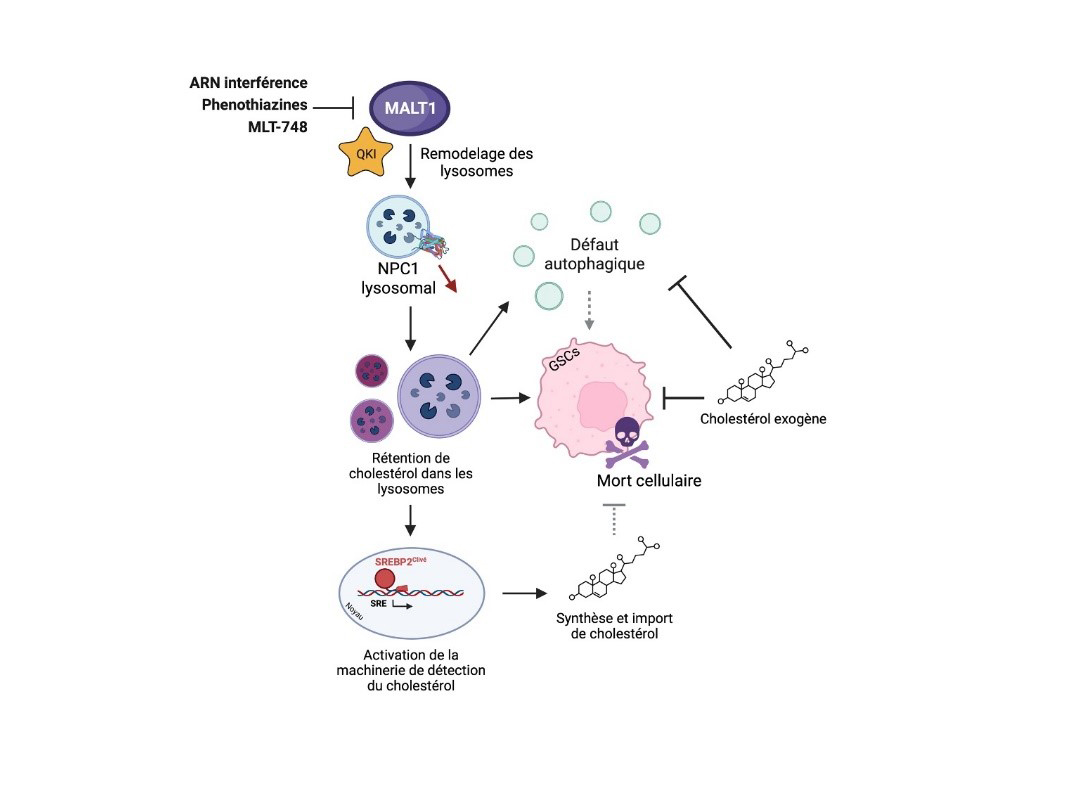
Figura: Modelo de acción de MALT1 en el mantenimiento de la homeostasis lisosomal
La proteasa MALT1 modula la localización lisosomal de la proteína NPC1 y la homeostasis del colesterol. En las células de tipo madre del glioblastoma (GSCs), inhibir la actividad de la paracaspasa MALT1 o interferir con su nivel de expresión remodela el compartimento lisosomal, reduciendo notablemente la cantidad del transportador de colesterol NPC1. Esto conduce a una retención intralisosomal de colesterol, induciendo un defecto en la degradación autofágica, la activación de la maquinaria que permite la importación y síntesis de colesterol, y finalmente, la muerte celular de las GSCs. Añadir colesterol exógeno a las GSCs cuya actividad de MALT1 ha sido inhibida permite contrarrestar parcialmente los fenotipos mencionados anteriormente, colocando así el transporte lisosomal del colesterol como un objetivo de las GSCs.
© Clément Maghe.
Un diluvio de colesterol lisosomal para destruir las células madre del glioblastoma
Los resultados de este estudio permiten entender mejor los engranajes del sistema. En efecto, sugieren que la represión de MALT1, mediante agentes farmacológicos o por interferencia de ARN (técnica que permite inhibir específicamente la síntesis de la proteína destruyendo el mensajero que le corresponde), modifica la homeostasis (el equilibrio entre el interior y el exterior) del colesterol. El colesterol se acumula entonces en las vesículas del compartimento de los lisosomas y endosomas tardíos. Esta falla en el abastecimiento de colesterol conduce a la muerte celular y a defectos de autofagia (sistema de auto-limpieza de la célula), que pueden ser parcialmente revertidos proporcionando a las células madre del glioblastoma, colesterol permeable a la membrana.
Estos resultados se han obtenido gracias a la combinación de un análisis por secuenciación de ARN (RNA-seq) y una cuantificación del proteoma, realizada en células madre del glioblastoma derivadas de pacientes y sometidas a un inhibidor farmacológico de la actividad protéolítica de MALT1.
Desde un punto de vista molecular, un análisis dirigido del proteoma de los lisosomas reveló que los transportadores de colesterol lisosomal del tipo Niemann-Pick C (NPC) están menos presentes cuando la actividad de MALT1 está impedida. De acuerdo con estos datos, bloquear farmacológicamente o apagar la expresión de estos transportadores NPC1/2 reproduce los efectos de la pérdida de función de MALT1, sugiriendo una acción similar de estas dos moléculas. Finalmente, la inhibición de MALT1 o de NPC1/2 ralentiza el crecimiento tumoral en modelos de ratones inmunodeprimidos, portando células madre del glioblastoma provenientes de pacientes.
Este trabajo ha permitido la cartografía de los eventos a nivel subcelular, participando en la desestabilización lisosomal inducida por el objetivo molecular y farmacológico de la paracaspasa MALT1. Estos datos hacen emerger la idea de que las propiedades y el mantenimiento de las células madre del glioblastoma descansan en la homeostasis del colesterol lisosomal.
Referencia:
The paracaspase MALT1 controls cholesterol homeostasis in glioblastoma stem-like cells through lysosome proteome shaping.
Maghe C, Trillet K, André-Grégoire G, Kerhervé M, Merlet L, Jacobs KA, Schauer K, Bidère N, Gavard J. Cell Rep. 2024 Jan 5;43(1):113631.
DOI: Cell