Entre estas enfermedades se encuentra la tristemente célebre enfermedad del sueño, causada por un parásito llamado Trypanosoma brucei. Este parásito se transmite a humanos y animales a través de la picadura de la mosca tsetsé. En humanos, causa graves trastornos neurológicos y en los animales provoca la nagana, una enfermedad que afecta gravemente al ganado.
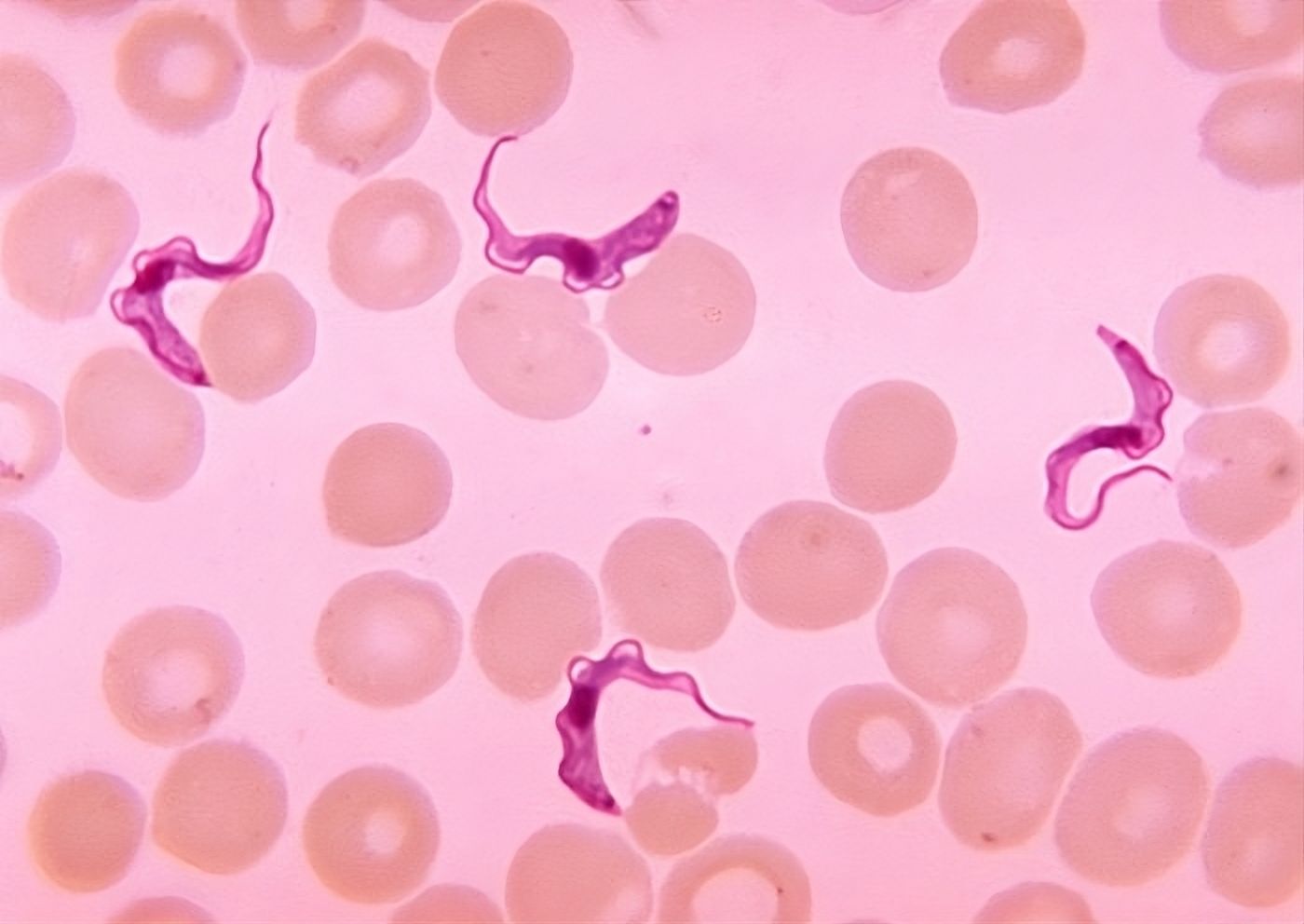
Trypanosoma brucei en la sangre de un paciente con tripanosomiasis humana africana, comúnmente llamada enfermedad del sueño.
Imagen Wikimedia
El panorama se oscurece aún más al considerar que los tratamientos actuales son escasos, tóxicos y cada vez menos eficaces debido a la aparición de resistencias.
En este parásito, una mitocondria única cambia de forma y función
A diferencia de la mayoría de las células vivas que poseen varias mitocondrias (las "centrales energéticas" de la célula), Trypanosoma brucei solo tiene una, que cambia completamente de forma y funcionamiento según el entorno, implicando mecanismos de fusión y fisión de membranas.
En la mosca tsetsé, la mitocondria del parásito adopta una forma reticulada, de gran tamaño y muy activa, produciendo energía mediante un proceso complejo llamado fosforilación oxidativa. Pero una vez en la sangre del mamífero, la mitocondria del parásito se reduce considerablemente a la forma de un simple tubo, y el parásito utiliza principalmente azúcares (la glucosa) para producir energía, mediante un proceso mucho más simple: la glucólisis.
En la mayoría de los seres vivos, las mitocondrias son muy dinámicas: se fusionan o dividen constantemente para adaptarse a las necesidades de la célula. Estos procesos, bien descritos en células de mamíferos o en la levadura Saccharomyces cerevisiae (la levadura de panadería) están regulados por proteínas de la familia de las dinaminas. Estas proteínas poseen un dominio que hidroliza el GTP y estructuras que les permiten unirse a las membranas y oligomerizarse.
En Trypanosoma brucei, la mitocondria forma una red única y continua, muy particular, que solo se divide cuando la célula misma se divide. Hasta hace poco, solo se habían identificado proteínas implicadas en la fisión (la división de las mitocondrias) en este parásito. Las proteínas responsables de la fusión, presentes en humanos o levaduras (como Mfn u Opa1), parecían simplemente ausentes, sugiriendo un mecanismo de fusión diferente.
Una nueva proteína de la familia de las dinaminas podría estar detrás de esta particularidad
En un artículo publicado en la revista Current Biology, los científicos descubrieron en Trypanosoma brucei un nuevo tipo de proteína de la familia de las dinaminas, bautizada TbMfnL (Trypanosoma brucei Mitofusina-Like). Esta proteína parece provenir de una antigua familia de proteínas, presente en muchos seres vivos (incluyendo algunas bacterias), pero ausente en mamíferos y levaduras. Por lo tanto, podría ser un vestigio antiguo de un mecanismo de remodelación de membranas celulares.
Sus resultados muestran que TbMfnL está anclada en la membrana interna de la mitocondria, del lado de la matriz (el interior de la mitocondria), lo cual es inédito para proteínas que remodelan membranas mitocondriales. Al aumentar la producción de TbMfnL en la célula, los científicos observaron un fuerte incremento en la interconexión y ramificación de los filamentos mitocondriales, mecanismo dependiente de la hidrólisis del GTP, que proporciona la energía necesaria. En otras palabras, TbMfnL sería capaz de modular la forma de la mitocondria desde el interior, mediante un mecanismo totalmente diferente al observado en otros eucariotas.
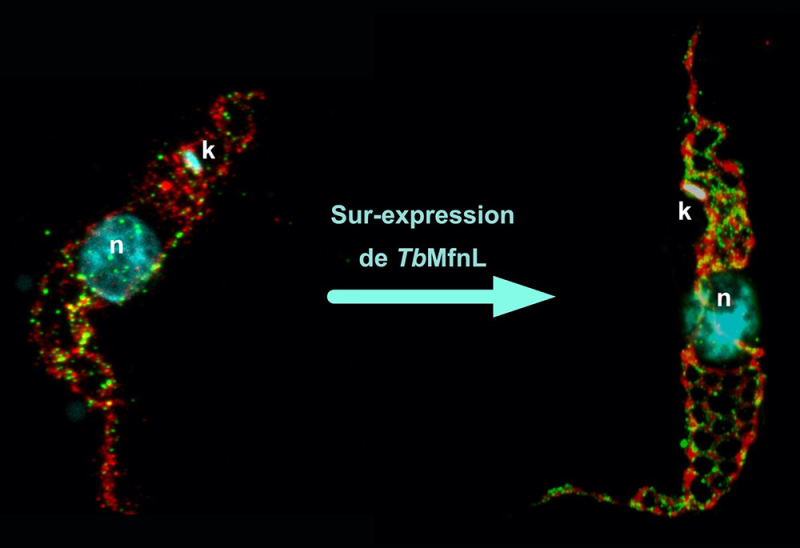
Marcaje de la mitocondria de un tripanosoma salvaje y sobreexpresando la proteína TbMfnL mediante microscopía de expansión. Rojo, marcaje de la matriz mitocondrial (Treonina deshidrogenasa, Tdh); Verde, marcaje membranario de la proteína TbMfnL; Cian, marcaje del núcleo (n) y del ADN mitocondrial (k, kinetoplasto).
© Emmanuel Tetaud
Este descubrimiento abre el camino a una nueva comprensión de los mecanismos de estructuración de las membranas mitocondriales y, en general, de las membranas celulares, no solo en Trypanosoma brucei, sino también en otros organismos. A largo plazo, este hallazgo podría permitir atacar al parásito de manera más eficaz, dirigiéndose a un elemento esencial y exclusivo de él. Y quizás, desarrollar tratamientos más específicos, menos tóxicos y que respeten las células humanas.