A questão fundamental que permanece: o que confere a certas fibrilas a capacidade de se propagarem com a rapidez de agentes infecciosos, enquanto outras evoluem muito mais lentamente ao longo de muitos anos?
Para responder a isso, cientistas criaram em laboratório uma fibrila específica de α-sinucleína, batizada de 1B, e a injetaram no cérebro de camundongos. Essa entidade sintética induziu o aparecimento muito rápido de inclusões patológicas semelhantes às observadas na AMS. Os resultados deste estudo, publicados na revista Nature, trazem uma nova luz sobre os mecanismos de propagação das sinucleinopatias.
A autorreplicação observada em escala atômica
Com o auxílio da crio-microscopia eletrônica, que permite estudar a estrutura das proteínas em escala atômica, os cientistas observaram as fibrilas sintéticas antes da inoculação (1B) e aquelas produzidas no cérebro sob o efeito da inoculação (1BP). As duas estruturas revelam-se quase idênticas.
A 1BP conserva a mesma arquitetura de dobramento, emparelhamento e empilhamento que a 1B. Essa similaridade demonstra que a fibrila sintética 1B gerou sua própria cópia no organismo, um processo que corresponde a uma verdadeira autorreplicação in vivo. A existência de tal fenômeno nunca havia sido demonstrada até agora em escala atômica em animais, nem mesmo para os príons. Os homogenatos diluídos de cérebro de camundongos contendo essas fibrilas 1BP podem, por sua vez, transmitir a patologia a outros animais por reinjeção.
Rumo a uma melhor compreensão e a novas estratégias terapêuticas
Os cientistas também identificaram regiões estruturais particulares que parecem desempenhar um papel central na capacidade dessas fibrilas de se multiplicarem e escaparem dos sistemas celulares de degradação.
"Este trabalho fornece a evidência experimental de que um mecanismo replicativo conformacional - do tipo príon - está em ação nas sinucleinopatias", destaca François Ichas. "Ele abre perspectivas para compreender como certas formas de agregação da alfa-sinucleína se tornam patogênicas e para conceber estratégias que visam interromper esse processo."
Este trabalho fornece um modelo experimental robusto dos mecanismos do tipo príon que sustentam a AMS e outras sinucleinopatias, como a doença de Parkinson ou a demência por corpos de Lewy. Ele também esclarece as bases estruturais supramoleculares que diferenciam essas patologias.
A longo prazo, a identificação das interfaces críticas expostas pelas fibrilas 1B poderia orientar a concepção de inibidores capazes de impedir sua propagação. Essa descoberta também convida a repensar as fronteiras entre entidades biológicas e agentes patogênicos de origem artificial.
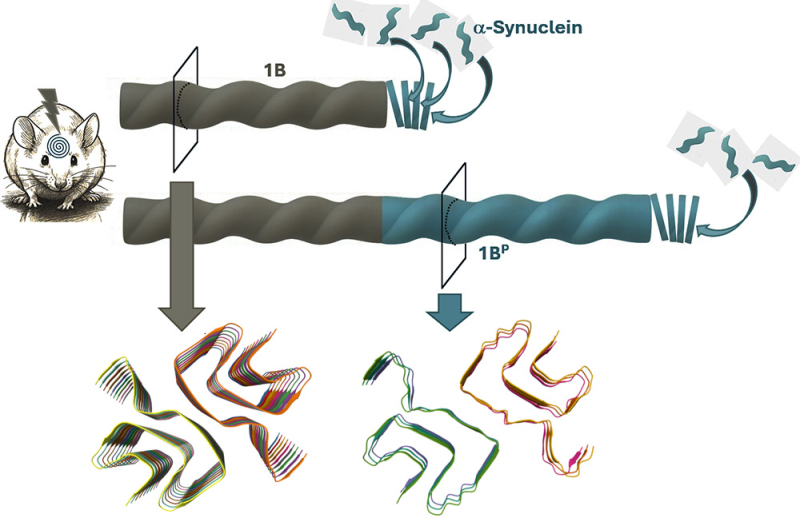
As fibrilas de α-sinucleína 1B (sintéticas) e 1BP (formadas no cérebro de camundongos injetados) compartilham uma estrutura quase idêntica, prova de que a 1B se autorreplica in vivo. As estruturas tridimensionais da 1B e da 1BP podem ser exploradas no site www.rcsb.org com os códigos 9EUU e 9RZF, respectivamente.
© François Ichas